熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
研究團隊開發了一種高度柔性的神經袖套,結合了電化學驅動的導電聚合物軟致動器與低阻抗微電極。這種設計能夠在僅需幾百毫伏的應用電壓下實現主動抓握或環繞精細神經的能力。通過大鼠模型進行的體內驗證顯示,這些神經袖套可以形成并維持一個自我封閉且可靠的生物電子接口與坐骨神經相連而無需使用外科縫合線或粘合劑。研究中還探討了不同厚度的導電聚合物聚吡咯(PPy)層對致動性能的影響,發現厚度的變化能夠影響彎曲幅度和響應時間。此外,研究證明了該裝置在重復操作下的穩定性和可靠性,并通過細胞毒性實驗確保了其生物相容性。其具有潛在的應用于治療慢性神經痛、運動障礙、代謝性疾病以及假肢肢體閉環控制的可能性。
研究亮點
1.開發了結合電化學驅動的導電聚合物軟致動器與低阻抗微電極陣列的高度柔性的神經袖套,只需幾百毫伏的電壓即可控制袖套的彎曲幅度和方向。2.摻雜十二烷基苯磺酸鹽(PPy(DBS))的聚吡咯作為驅動材料,以達到需要的體積變化。
研究背景
傳統的周圍神經接口通常需要復雜的植入手術,這些手術可能帶來較高的神經損傷風險。因此,研究人員致力于開發一種微創的神經接口系統,以減輕這些風險。周圍神經接口在生物電子醫學中扮演著越來越重要的角色,已經被用于治療慢性神經痛、運動障礙、代謝性疾病等。
研究內容
研究者介紹了一種軟機器人薄膜生物電子周圍神經袖帶,它集成了數十個分布式高分辨率微電極和基于導電聚合物的雙層致動器,可以通過可編程電輸入進行控制。研究者選擇了摻雜十二烷基苯磺酸鹽(PPy(DBS))的聚吡咯作為驅動材料,因為它在電化學刺激下會發生巨大的體積變化。當施加輕微的負電壓時,由于溶劑化陽離子(例如Na+)被拉入聚合物基質中,聚合物會發生體積膨脹。相反,正電壓會導致陽離子被驅逐回電解質,從而導致聚合物收縮。通過利用這種可逆電化學過程,由PPy(DBS)涂覆的金(Au)形成的雙層結構表現出可控的彎曲行為。
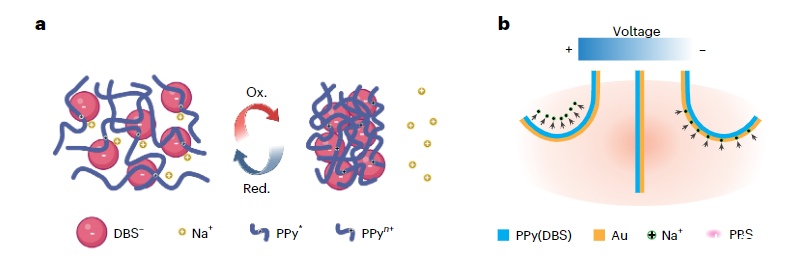
圖1:a.電化學過程中PPy(DBS)因Na+等小陽離子的傳輸而引起的巨大體積變化。b.PPy(DBS)/Au雙層致動器在PBS溶液中垂直于薄膜表面來回的可逆彎曲運動。
通過在0.1 M NaDBS/0.1 M吡咯溶液中施加2 mA cm-2的恒定電流,研究者們以電化學方式將PPy(DBS)沉積在Au涂覆的聚對二甲苯C(PaC)薄膜上。在薄膜沉積過程中,帶負電的大體積陰離子DBS-被納入聚合物基質中,以保持整體電荷中性。
總體而言,薄膜厚度隨著沉積電荷量線性增加,每C cm-2增加約6.7μm。隨著薄膜變厚,它往往變得越來越不均勻,受到壓實密度增加。研究者們通過在0.1 M NaDBS中以10 mV s-1進行循環伏安法(CV)掃描來預處理薄膜,以完全激活PPy(DBS)。最初,該裝置是平坦的,但經過幾次CV掃描后,它轉變為卷曲狀態,并伴隨著不可逆電流,在第一個周期中尤其明顯。即使在沒有任何施加電壓的情況下,預處理最終也會導致完全卷曲的狀態。較高的頻率涉及參與反應的陽離子較少,因此導致彎曲幅度逐漸減小。這種現象與陽離子移動穿過聚合物基質所需的時間有關。具有不同PPy(DBS)厚度的器件的性能表現出一致的趨勢。一般來說,彎曲幅度隨著轉移電荷量的增加而增加,并且高度依賴于PPy(DBS)的厚度。
研究者驗證了袖帶在體外自動包裹神經的能力,將絕緣線作為坐骨神經模型,浸入PBS溶液中并放置在瓊脂糖凝膠上。導線和凝膠之間保持一個小間隙,允許裝置通過。在逐步施加從-0.4到0.4 V的電壓時,該裝置慢慢地纏繞在模型上并逐漸收緊,直到形成牢固的抓握,并在施加-0.4 V的電壓時釋放。
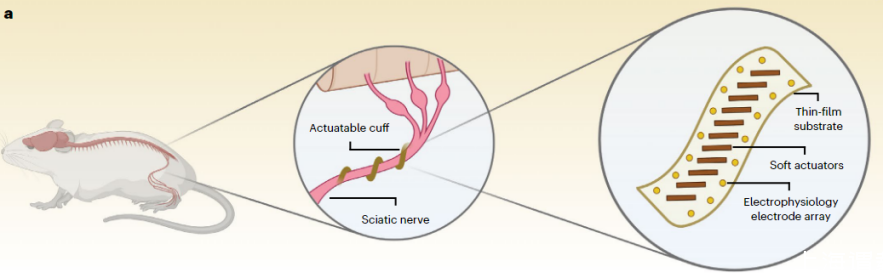
圖2:軟執行器集成神經袖帶電極和柔性神經套囊主動包裹坐骨神經以實現無需縫合的親密界面的概念示意圖。
研究前景
研究者們將繼續探索如何通過優化材料和設計來提高電極陣列的性能,例如通過改進導電聚合物的性能,使袖套能夠更好地適應神經的形狀和尺寸。同時利用傳統的微制造技術,可以進一步完善薄膜設備的設計,集成精確圖案化的致動元件和微電極陣列,實現更低電壓驅動下的形狀變換。未來的研究可能會更多地采用有限元分析來深入理解不同設計因素之間的相互作用,以及它們如何影響螺旋致動行為,特別是極端彎曲條件下的表現。另外,盡管已經進行了初步的體內驗證,但仍需要進一步研究以確保該技術的長期生物相容性和穩定性。
 相關新聞
相關新聞