熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
海洋冷泉中“海底微生物甲烷過濾器”的效率受上覆海水的擴散硫供應和深層水庫的平流甲烷通量控制。高流體通量會降低硫酸鹽的滲透深度,并將過濾器限制在靠近沉積物-水界面的非常狹窄的區(qū)域。在這里,我們介紹了一種新的通過(槽)系統(tǒng)的沉積物流,以模擬天然沉積物中流體/甲烷流和硫酸鹽供應之間的平衡。槽能夠在自然流態(tài)下對完整的沉積巖芯進行厭氧培養(yǎng)。除了傳統(tǒng)的流入和流出取樣外,還可以使用微傳感器和根瘤菌沿沉積物巖芯監(jiān)測地球化學參數(shù)。在第一次試運行中,在低(11.2 cm y–1)和高流體流量(112.1 cm y–1)條件下,對來自埃克恩費爾德灣(波羅的海)的兩個含氣沉積物巖芯進行了310天的培養(yǎng)和監(jiān)測。與低流量(0.29 mmol m–2 d–1)相比,高流量下的甲烷厭氧氧化速率(AOM)高出一個數(shù)量級(3.07 mmol m–2 d–1),而甲烷流出量則高出一倍(分別為0.063和0.033 mmol m–2 d–1)。硫化物、硫酸鹽、總堿度、pH值、氧化還原和其他參數(shù)的沉積物剖面提供了沉積物巖心生物地球化學反應性質和動力學的重要信息,包括甲烷營養(yǎng)、硫酸鹽還原、碳酸鹽沉淀和硫化物氧化。槽系統(tǒng)被證明是研究受平流流體輸送影響的完整沉積物中生物地球化學參數(shù)時間演化的有效裝置。
海洋沉積物蘊藏著地球上最大的甲烷儲層,包括甲烷水合物(Burwicz et al.2011;Wall-mann et al.2012)。其中一部分甲烷從更深的地方遷移到冷泉處的沉積物表面,并被排放到水柱中。在水深較淺且排放率較高的地方,這種甲烷可以進入大氣層,形成全球溫室氣體庫。然而,大多數(shù)海洋甲烷已經被沉積物和水柱中的微生物過程所消耗(Reeburgh 2007)。
迄今為止,已經描述了微生物甲烷氧化的幾種代謝途徑,包括有氧途徑和以硝酸鹽(Ettwig et al.2010)、鐵(Beal et al.2009)或硫酸鹽(Boetius et al.2000)為末端電子受體的幾種厭氧途徑。甲烷與硫酸鹽的厭氧氧化(AOM)是海洋沉積物中主要的甲烷氧化途徑,在甲烷到達水柱之前消耗了80%以上的甲烷(Hinrichs和Boetius,2002年;Reeburgh,2007年)。
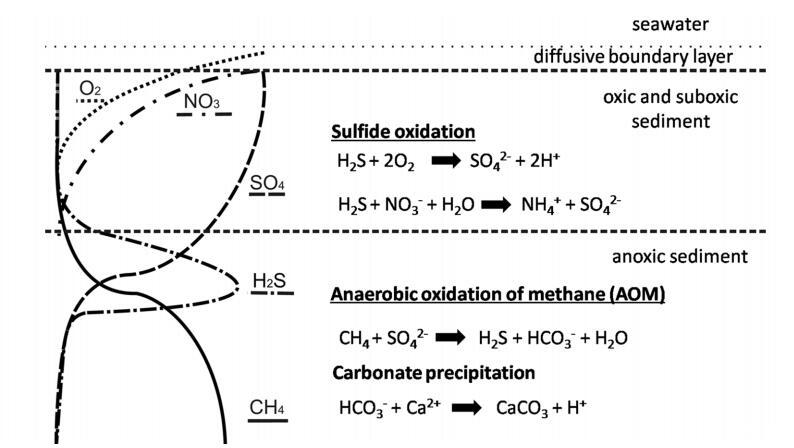
圖1:。冷泉特征生物地球化學過程示意圖。電子受體氧(虛線)、硝酸鹽(寬虛線)和硫酸鹽(虛線)的滲透。甲烷(實線)與滲流流體平流。硫化物(緊密虛線)和碳酸氫鹽是由甲烷的厭氧氧化(AOM)產生的,由甲烷營養(yǎng)古菌和硫酸鹽還原菌聯(lián)合體介導。自生碳酸鹽沉淀,硫化物被化能自養(yǎng)生物氧化。
在海洋陸架和大陸邊緣,AOM活動主要出現(xiàn)在沉積物的上部10 m處。AOM區(qū)域(圖1)通常被稱為“底棲甲烷過濾器”(Sommer et al.2006)。AOM是由微生物聯(lián)合體介導的,這些微生物利用硫酸鹽作為電子受體。這些菌群由硫酸鹽還原菌(SRB)和厭氧甲烷營養(yǎng)古菌(ANME)組成(Boetius et al.2000)。AOM財團減少硫酸鹽并氧化甲烷,生成硫化物和碳酸氫鹽(方程式1):
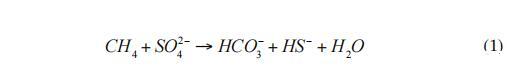
在一項新的研究中,Milucka等人(2012)提出了一種不同的反應機制。在這一途徑中,ANME-2古菌通過產生元素硫作為中間產物單獨氧化甲烷,進一步與二硫化物或其他多硫化物反應(式2):
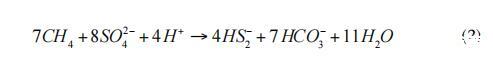
硫酸鹽還原菌使用二硫化物,并以7:1的比例將其不成比例地轉化為硫化物和硫酸鹽(式3):
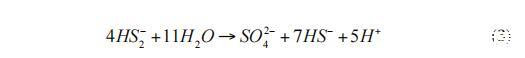
產生的硫酸鹽可被古細菌再次用于甲烷氧化。通過組合式2和式3,得出式1的凈反應。
在沉積物中,甲烷和硫酸鹽同時耗盡的層位被稱為硫酸鹽-甲烷過渡帶(SMTZ)(Iversen和J?rgensen 1985;Knittel和Boetius 2009)。在該區(qū)域,溶解無機碳(DIC)和硫化物(AOM的產物)顯著增加。這兩種產物也可以抑制反應。當孔隙水中存在高濃度的硫化物時,硫化物被認為是AOM反應本身的直接熱力學抑制劑(Treude et al.2003;Zhang et al.2010)。在高AOM活性下,碳酸氫鹽與鈣反應形成自生碳酸鹽(Peckmann et al.2001):該反應可通過降低沉積物的孔隙度或阻斷流體通道間接抑制AOM(Treude et al.2003;Luff and Wallmann 2003;Kutterolf et al.2008;Karaca et al.2010),從而延緩甲烷的供應。
SMTZ的深度取決于硫酸鹽的消耗率、下方甲烷的通量(Borowski等人,1999年),有時甚至取決于滲漏生物的活動(Cordes等人,2005年;Fischer等人,2012年)。除了甲烷營養(yǎng),硫酸鹽還原是海洋沉積物中有機物最重要的厭氧降解過程(J?rgensen 1978);因此,硫酸鹽滲入沉積物的深度還可以由有機質輸入和埋藏率決定(Borowski et al.1999)。在沿海沉積物中,由于有機碎屑硫酸鹽還原對硫酸鹽的消耗率很高,SMTZ通常位于海底以下幾十米處,而在有機質貧乏的深海沉積物中,SMTZ的深度可能在地表以下幾十米(Borowski 2004)。在有來自下方的平流甲烷供應的地方,如冷泉和泥火山,即使在深海環(huán)境中,SMTZ也可能非常淺,在前10 cm內顯示硫酸鹽耗盡(Treude et al.2003;Niemann et al.2006)。流體的平流輸送產生了更強的甲烷通量,但也限制了硫酸鹽的穿透深度。在這些地點,SMTZ深度的水平變異性通常很高,可以在分米尺度上變化(Treude et al.2003;Niemann et al.2006)。有時,即使在40 cm的橫向距離內,也可以觀察到底棲通量和AOM活動的強烈變化(Linke et al.2005)。化學合成滲漏動物群,如硫細菌墊、管蠕蟲和蛤蜊,在硫化物上生長旺盛,可作為AOM活性和甲烷通量的指標(Sahling et al.2002;Torres et al.2002;Levin et al.2003;Treude et al.2003;Mau et al.2006)。
除了空間變異性外,流體通量和相關甲烷供應以及SMTZ深度的相應變化也可能暫時變化。短期流體流動波動可由阻塞的流體路徑造成,例如通過天然氣水合物的自發(fā)形成或碳酸鹽的預循環(huán)(Luff et al.2004、2005),這迫使形成新的運移路徑,或通過潮汐壓力變化(Tryon et al.2002;LaBonte et al.2007;R?y et al.2008;Boles et al.2001)。
流體流動也可能在很大的時間和空間尺度上發(fā)生變化。地震可以引起強烈的流體流動脈沖或產生斷層,從而成為流感病毒的新遷移途徑(Tryon et al.2002;Hensen et al.2004;Aiello 2005;Hen-rys et al.2006;Mau et al.2007;Praeg et al.2009;Meister et al.2011)。地震也可能引發(fā)邊坡破壞,隨后導致質量浪費。大陸坡上的大規(guī)模浪費被懷疑會引發(fā)暴露的天然氣水合物釋放甲烷(Ranero et al.2008;Manga et al.2009)。據(jù)推測,甲烷通量的另一個長期變化是由全球變暖引起的。海底變暖將降低淺層海底天然氣水合物的穩(wěn)定性,并增加甲烷通量(Kvenvolden 1993;LaBonte 2007)。由于北冰洋受到全球變暖的強烈影響,并且由于低溫,與其他海洋相比,天然氣水合物的穩(wěn)定性較淺,因此該區(qū)域可能是首批顯示天然氣水合物中與溫度相關的甲烷釋放的區(qū)域之一(Buffett和Archer 2004;Biastoch et al.2011)。
上述例子表明,從海底流出的甲烷通量在空間和時間尺度上都可能變化很大。了解底棲微生物甲烷過濾器對這些生長和活動變化的反應并不容易,因為很難在實驗室模擬自然情況,也很難在現(xiàn)場進行適應。之前曾多次嘗試使用流通系統(tǒng)研究AOM活動和動力學,即甲烷飽和海水連續(xù)流過沉積物的系統(tǒng),以下段落簡要總結了這些系統(tǒng)(直接比較見表1)。
Girguis等人(2003、2005)開發(fā)了一種連續(xù)流厭氧甲烷培養(yǎng)系統(tǒng)(AMIS),以測定ANME的生長速率。AMIS使用完整的沉積物巖心,從底部輸送富含甲烷的海水(包括硫酸鹽),從頂部輸送不含甲烷的海水(包括硫酸鹽)。在反應器中制備海水,以確保在大氣壓下甲烷濃度恒定。
在實驗期間獲得的子樣本中確定AOM率。實驗前后測定了ANME生物體的細胞豐度。ANME-2在低甲烷通量條件下的生長速率最高,而ANME-1在高甲烷通量條件下的生長速率更快。
Meulepas等人(2009年)在大氣壓力下使用了一個流動式膜生物反應器,該反應器充滿沉積物,并由人工海水(20 mmol L–1硫酸鹽)供應。甲烷通過生物反應器永久滲濾。速率由懸浮沉積物物質培養(yǎng)過程中13CH4的周轉率確定。運行884天后,觀察到非常高的AOM率(286μmol g干重–1 d–1)以及3.8個月的細胞倍增率。
Wegener和Boetius(2009)在大氣壓下使用流動培養(yǎng)反應器,以高流速的富含甲烷的人工海水培養(yǎng)沉淀泥漿。在恢復甲烷供應后,忍受了40天的饑餓時間,但沒有導致活動減少。相反,硫酸鹽濃度降低(1 mmol L–1)導致AOM活性下降50%。
Deusner等人(2010年)使用了加壓系統(tǒng)(最大35 bar),該系統(tǒng)將溶解甲烷的濃度增加至70 mmol L–1,并使AOM速率比常壓下的甲烷濃度高10-15倍。除了泵和壓縮機之外,該系統(tǒng)還包括一個用于向介質中富集甲烷的有條件容器和一個用于培養(yǎng)沉淀泥漿的生物反應器。
Zhang等人(2010)還開發(fā)了一種高壓/高甲烷流通系統(tǒng),以防止孵化期間硫化物的抑制。該系統(tǒng)配有一個條件容器、高壓泵和一個孵化ves-sel。進出口為硫化物測定提供取樣。
Wankel et al.(2012)使用類似于AMIS的流通系統(tǒng),底部溫度梯度在90°C到頂部約22°C之間,以孵化熱液噴口沉積物。完整的沉積物巖芯從下方供應富含甲烷(2.8 mol L–1)的缺氧海水介質(硫酸鹽28 mmol L–1),流體流量約為330 cm y–1。AOM率是根據(jù)流入和流出中d13C甲烷和d13C DIC的自然濃度計算的。該研究表明,AOM在高溫(90°C)下與硫酸鹽還原脫鉤,這可能與鐵還原耦合。
開發(fā)上述流通系統(tǒng)和生物反應器是為了促進AOM生物體的最佳生長條件(Girguis et al.2003;Meulepas et al.2009),或通過單獨調整系統(tǒng)來分析選定因素的影響(Wegener和Boetius 2009;Deusner et al.2010;Zhang et al.2010;Wankel et al.2012)。在大多數(shù)情況下,使用的是沉積物泥漿,而不是完整的沉積物巖心(表1)。然而,在天然甲烷滲漏處,條件與傳統(tǒng)的人工設置非常不同。最重要的是,甲烷和硫酸鹽從不同的方向以不同的速度供應:甲烷與來自更深來源的流體平流,而硫酸鹽通過分子擴散從上覆水柱輸送(Borowski et al.1996)。此外,甲烷供應的變化通常與流態(tài)的變化相關(Tryon等人,2002年;Tryon和Brown 2004年;Linke等人,2005年;LaBonte 2007年;Füri等人,2010年)。因此,海底甲烷過濾器不僅受到甲烷供應量增加的挑戰(zhàn),還受到電子受體(即硫酸鹽)穿透深度變淺的進一步壓力(Niemann et al.2006)。最后,天然(完整)沉積物與實驗室沉積物泥漿(均質沉積物-海水混合物)具有非常不同的特性(例如,孔隙度、滲透率、濃度梯度)。迄今為止,Girguis et al.(2003)和Wankel et al.(2012)的水流系統(tǒng)是唯一使用完整沉積物巖心的系統(tǒng)。然而,該系統(tǒng)缺乏技術可行性,無法監(jiān)測堆芯內的生物地球化學隨時間的發(fā)展。因此,本研究的目的是開發(fā)一個新系統(tǒng),該系統(tǒng)能夠對AOM活動進行時序研究,并在整個巖芯長度上,將不同流體/甲烷流動狀態(tài)下完整沉積物巖芯中的生物地球化學參數(shù)關聯(lián)起來。槽系統(tǒng)有助于甲烷和硫的自然供應,并在實驗期間監(jiān)測生物地球化學梯度。在首次使用波羅的海Eckernf?rde灣的含氣沉積物應用該系統(tǒng)時(例如,Treude et al.2005),我們重點關注以下研究問題:
底棲微生物甲烷過濾器和地球化學梯度如何對變化的流體和甲烷流動狀態(tài)作出反應,以及達到穩(wěn)定狀態(tài)的反應時間有多長?
在甲烷供應增加和硫酸鹽滲透減少的情況下,底棲甲烷過濾器去除甲烷的效率如何?
插槽系統(tǒng)
槽系統(tǒng)設計用于模擬原狀沉積物巖心中的自然滲流條件,其中甲烷從底部平流輸送,硫酸鹽從巖心頂部擴散供應。根據(jù)Widdel和Bak(2006),用于提供電子受體和供體的液體由硫酸鹽還原菌的缺氧海水培養(yǎng)基組成。缺氧硫酸鹽介質(SO42–濃度19 mmol L–1,鹽度22 psu,根據(jù)研究地點的自然濃度:Whiticar 2002;Treude et al.2005),用于模擬“海水”條件,即允許從沉積物表面擴散硫酸鹽供應,無甲烷。甲烷富集培養(yǎng)基(CH4濃度約930μmol L–1,鹽度22 psu),用于模擬下方的“滲流”條件,無硫酸鹽。在下文中,這兩種介質根據(jù)其流動方向和成分被稱為“海水”和“滲流”介質。海水介質從帶有氮氣頂空的單個儲液罐中輸送(圖2)。為了提供滲流介質,該系統(tǒng)由兩個相連的儲層組成,其中一個儲層為氮氣(儲層1),另一個儲層為甲烷(儲層2)。儲層2通過蠕動泵將富含甲烷的介質直接輸送至沉積巖芯底部(詳情見下文)。一旦儲層2中的介質液位降低,產生輕微的欠壓,就從儲層1中補充新介質(氮氣頂空)。在儲層2中,來自儲層1的介質富含甲烷。通過讓進入的介質通過甲烷頂空下落,增強了甲烷頂空與介質之間的平衡。
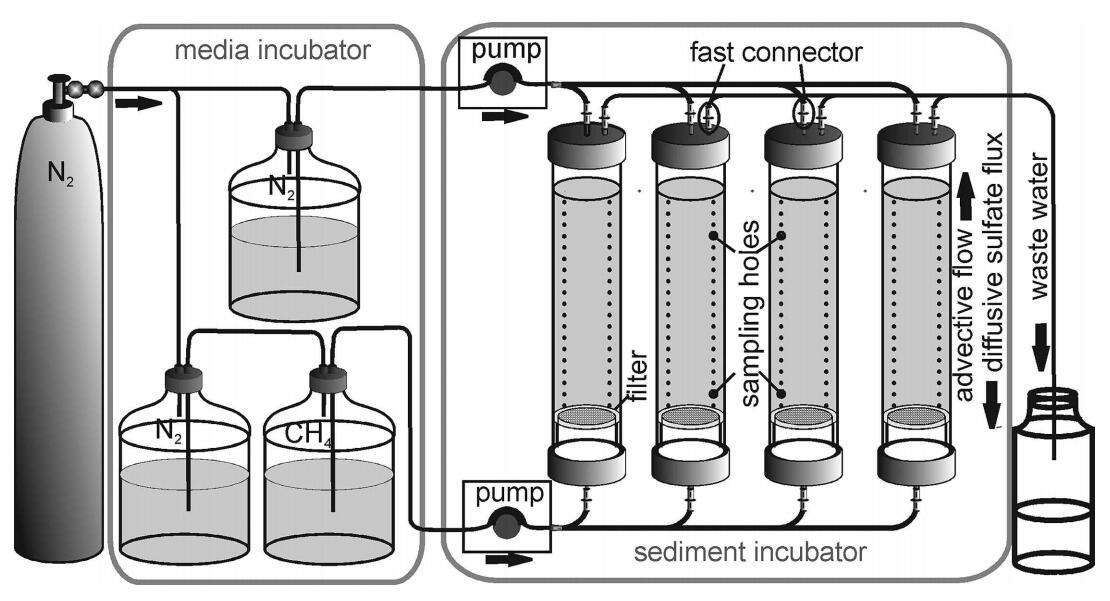
圖2:。插槽系統(tǒng)示意圖。將培養(yǎng)基儲液罐儲存并在10°C的冰箱柜中冷卻。培養(yǎng)基從頂部進入堆芯,模擬缺氧海水。富含甲烷但不含硫酸鹽的下部介質從底部進入巖芯,模擬流體滲流。CH4儲層中的滲流介質富含甲烷。所有介質均通過泵和管道輸送。所有磁芯均配有快速連接器,以避免斷開時空氣侵入,并配有三行21個硅密封孔用于取樣。沉積物芯下方的玻璃纖維過濾器防止沉積物流失到槽系統(tǒng)的下部。流出的廢水(頂部)收集在一個瓶子中。
為了追蹤巖心內滲流介質的遷移,我們使用溴作為惰性示蹤劑。雖然溴在滲流介質中以標準濃度(560μmol L–1)存在,但在海水介質中僅以痕量濃度(6μmol L–1)存在。Resazurin被用作兩種介質中氧污染的指示劑(Visser等人,1990年)。有關介質組成的更多詳細信息,請參閱下文(“實驗設置”和表2)。所有培養(yǎng)基均儲存在10°C的冰箱柜中,避光保存。
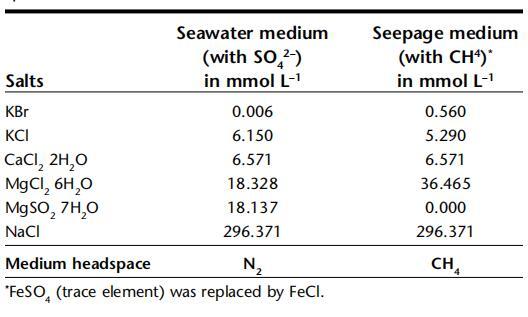
表2:。槽系統(tǒng)中使用的兩種不同介質的鹽濃度。含硫酸鹽的海水介質從頂部輸送,含甲烷的滲流介質從底部輸送,不含硫酸鹽。在最后一行中,表示介質頂部空間的氣體。
在該系統(tǒng)中,介質由蠕動泵(Medorex TL/10E,最小/最大泵容量0.1μL min–1/400μL min–1)使用Santropen(可高壓滅菌、高柔性、高抗腐蝕)管(內徑0.5 mm,外徑1.6 mm)輸送。在氮氣供應(氣罐)、介質儲罐和泵之間以及泵和沉積物芯之間,使用了Iso Versenic(可高壓滅菌、非常耐腐蝕、非常低的氣體滲透性)管(內徑1 mm,外徑3 mm)。管接頭由聚丙烯制成(Brandt GmbH)。
聚碳酸酯芯襯(氣密,總長30 cm,內徑6 cm,外徑6.8 cm;圖3D)配有三條垂直的取樣孔線(每條線21個孔,直徑4 mm,取樣孔之間的距離5.8 mm),并用無殘渣硅(Aquasil,Probau)密封。內襯在頂部和底部都用聚氯乙烯(PVC)制成的蓋子封閉(圖3A、3B)。這些蓋子(頂部和底部)有一個帶有分配器容器的流入管(圖3B)。流出口(僅頂蓋)位于該容器后面。丁腈橡膠(NBR)O形圈位于蓋的內邊緣,用于密封蓋和襯里之間的連接。在襯里的底部,固定一個過濾器支架(圖3C),以固定一個玻璃纖維過濾器(直徑6 cm,孔徑5μm)。過濾器防止沉積物顆粒進入分配器容器。沉積物芯通過快速連接器(聚丙烯,較冷的產品)連接到泵系統(tǒng),使管道易于連接和斷開,無需氧氣侵入。泵和泵芯儲存在冰箱中,溫度為10°C,且在黑暗中。有關SLOT系統(tǒng)中所用沉積物巖心的現(xiàn)場取樣和實驗設置的詳細信息,請參閱下面的“現(xiàn)場取樣(Eckernf?rde Bay)”和“實驗設置”。
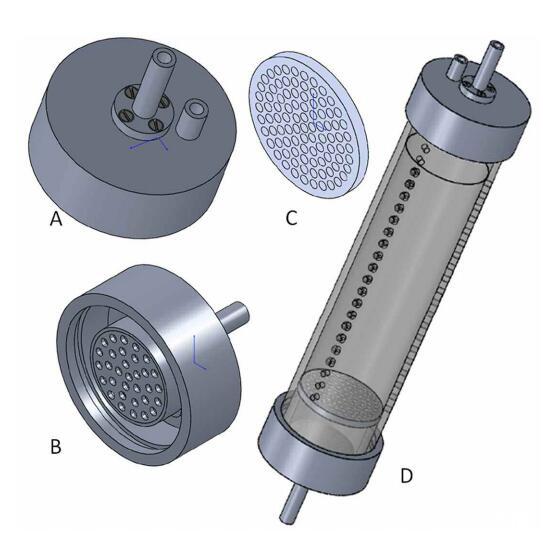
圖3:。槽襯套的單個組件。(A)頂蓋(外部視圖,PVC),帶進水管(中、長、分配容器未顯示)和出水管(短、右),(B)底蓋,帶進水管和分配容器(PVC),(C)帶開口的過濾器支架(PVC),(D)帶三行取樣孔的槽內襯(聚碳酸酯),內部配備過濾器支架(聚碳酸酯),頂蓋(進出口),和底蓋(流入口)。
插槽系統(tǒng)孵化期間的取樣程序和分析
在槽芯孵化期間,在孵育過程中的幾個時間點,使用硅填充取樣孔進行rhi-zons孔隙水亞取樣(Meijboom和Noordwijk 1991)或水平微傳感器測量(pH、氧化還原電位、硫化物;Revs-bech和J?rgensen 1986)(硫化物在32、80、129、169、234、303和360天后;pH在169、234、303和360天后;氧化還原電位在32、129、169、303和360天后;總培養(yǎng)時間376天)。
孔隙水取樣
對于使用根進行的孔隙水取樣(圖4C和4D),小心地從取樣孔中去除硅,并將用高壓鹽水(salin-ity 22 psu)預濕的根(根際,CSS-F,長5 cm,直徑2.5 mm,孔徑0.2μm)緩慢推入沉積物中。之后,在孔周圍用無殘留硅(Aquasil、Probau)密封根瘤,并在整個培養(yǎng)時間內保持在沉積物芯內。對于重復的孔隙水取樣,從根中去除前0.5 mL殘留水并丟棄。隨后,對1.0-1.5 mL孔隙水進行取樣(3 mL luer lock注射器,Becton,Dickinson and Company),并將其轉移至2 mL塑料瓶(安全鎖管,2 mL,Eppendorf)中,用于隨后的總堿度(TA)、硫酸鹽、溴化物和氯化物分析(見下文)。根據(jù)Seeberg-Elverfeldt et al.(2005),我們計算,最多只能對3 mL孔隙水進行取樣,以避免相鄰深度段的交叉取樣。

圖4:。槽芯取樣程序:(a)通過帶有pH針傳感器(左)和參考針電極(右)的硅填充取樣孔進行微傳感器測量;(b)用硼硅酸鹽注射器和快速接頭進行流出取樣;(c)核心底水中的微傳感器和根線;(d)穿過硅密封取樣孔的針狀傳感器;(e)通過取樣孔使用根線進行孔隙水取樣。
在使用根瘤菌進行孔隙水取樣之前,使用硼硅酸鹽玻璃注射器(luer,5 mL,Poulton&Graf GmbH)對流出介質(圖4B)進行取樣,流出介質位于系統(tǒng)頂部,并通過一根等速管(5 mm長,3 mm直徑)連接到快速耦合器。兩種流入介質(“海水”和“滲流”)直接在將管道連接至巖心的快速連接器之前,使用管接頭和硼硅酸鹽注射器(見上文)進行取樣。對于甲烷樣品,將2 cm3培養(yǎng)基轉移到含有5 cm3 2.5%(w/v NaOH)的10 mL血清瓶中。立即用丁基橡膠塞關閉小瓶。剩余的樣品體積(約1.5-2 cm3)儲存在塑料瓶(安全鎖管,Eppendorf,2 mL)中,用于總堿度滴定和離子分析。
微傳感器分析
我們使用鋼針傳感器對沉積物巖心中的地球化學參數(shù)(pH、氧化還原電位、硫化物)進行微傳感器分析(Revsbech和J?rgensen 1986)(圖4A、D和E)。針式傳感器較不易損壞,并且很容易通過硅填充孔穿透芯襯套。然而,這種類型的傳感器通常比普通玻璃傳感器有更長的響應時間,這取決于溫度、傳感器年齡和沉積物類型。由于沉積物芯的溫度接近10°C(測量期間通過冷包穩(wěn)定),并且必須在室溫下進行測量,因此傳感器必須在每個測量點適應新的溫度,這增加了響應時間。因此,在穿過取樣孔后,允許傳感器在5到15分鐘之間進行調整,直到宣布某個值有效(至少為響應信號t90的90%)。測量以約2 cm的間隔進行,即每隔一個采樣孔進行一次,但沉積物-水界面除外,該界面上的測量直接在界面上方和下方進行。使用微電極公司(MI 411 B,量規(guī)20)的微型傳感器測量pH值。對于三點校準(pH 4.01、6.89和9.18),使用默克公司的標準pH緩沖液。使用Unisense、Den-mark(RD-N,尖端直徑0.8 mm)的傳感器或氧化還原針傳感器(MI-800,25號儀表,微電極公司)測量氧化還原電位。用pH值為4和7的緩沖液中飽和二氫喹啉溶液的兩點校準對傳感器進行校準。傳感器手冊提供了與標準氫電極(SHE)相關的氧化還原電位(mV)。硫化氫(H2S)由丹麥Unisense的針式微型傳感器測量(H2S-N,尖端直徑0.8 mm)。傳感器通過6種標準NaS溶液(0、100、200、500、1000、2000μmol L–1)進行校準,這些溶液在無氧磷酸鹽緩沖液(>4 pH)中制備,TiCl含量為10%v/v。根據(jù)Jeroschewski et al.(1996),使用H2S濃度、pH值、鹽度和溫度計算總硫化物濃度(包括H2S、HS-和S2-)。對于缺失的pH值曲線(運行32、80、129天),使用7.5的pH值(培養(yǎng)基制備pH值)。
實驗終止和巖心切片
在實驗結束時,用根瘤菌再次對孔隙水進行取樣(見上文)。這一次,提取了更大體積(每個取樣孔平均約4.3 mL)的銨、硝酸鹽和硫化物樣品(見下文分析)。拆除頂蓋和底蓋后,將芯放在擠出機上(直徑5.8 cm)。將兩個聚碳酸鹽亞巖芯(長26 cm,內徑2.5 cm,外徑2.6 cm)推入巖芯,以測定硫酸鹽還原和甲烷厭氧氧化(AOM)速率(見下文分析)。盡管子巖芯仍在沉積物中,但在擠出機的幫助下,將沉積物巖芯推到襯里外,并逐步切成1 cm的甲烷取樣間隔(2 cm3)和2 cm的孔隙度間隔(約1.5 cm3)、總CNS(孔隙度子樣本)和總有機碳(TOC,孔隙度子樣本)(見下文分析)。在2 cm的間隔內采集額外的樣本,用于未來的工作,如催化報告者沉積熒光原位雜交(CARD-FISH,0.5 cm3)、脂質生物標記物(~3 cm3)和RNA/DNA(2 cm3)分析。
 相關新聞
相關新聞