熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
人體微生物組包含多種微生物, 共享和競爭相同的環境利基 [1, 2]。 人體內主要的微生物生長形式是 生物膜狀態,其中緊密堆積的細菌、古菌和 真菌細胞必須合作和/或競爭資源 為了生存[3-6]。 我們檢查了由腸道微生物組的主要真菌物種組成的混合生物膜, 白色念珠菌,以及五種常見的胃腸道細菌:脆弱擬桿菌、梭狀芽孢桿菌 產氣莢膜桿菌、大腸桿菌、肺炎克雷伯菌和 糞腸球菌 [7-10]。 我們觀察到生物膜 由白色念珠菌形成,提供低氧微環境 支持兩種厭氧菌的生長,甚至 當在通常的環境有氧條件下培養時 對細菌有毒。 我們還發現,與生物膜中的細菌共培養會誘導生物膜中的大量基因表達變化。 白色念珠菌,包括 WOR1 的上調,其編碼 控制表型轉換的轉錄調節因子 C. albicans,從“白色”細胞類型到“不透明”細胞 類型。 最后,我們觀察到在懸浮培養中, 產氣莢膜梭菌誘導白色念珠菌聚集成 “微型生物膜”,允許產氣莢膜梭菌細胞存活 在通常有毒的環境中。 這項工作表明細菌和白色念珠菌的相互作用以多種方式調節其環境的局部化學以創造生態位 有利于它們的生長和生存。
真菌物種白色念珠菌形成混合生物膜 五種細菌
白色念珠菌,有或沒有產氣莢膜梭菌, 脆弱類桿菌、糞腸球菌、大腸桿菌、 或肺炎克雷伯菌細胞,粘附在牛血清包被的聚苯乙烯孔上 90 分鐘,并允許 形成生物膜 24 小時,這是生產白色念珠菌生物膜的標準程序 [11, 12]。 共焦掃描激光 顯微鏡 (CSLM) 圖像證實,在所有情況下, 真菌和細菌物種并入生物膜(圖 1)。 細菌附著在白色念珠菌菌絲和 酵母形式的細胞(圖 1;圖 S1A-S1F 可在線獲取)。 而 B. fragilis 和 C. perfringens 對 生物膜結構,大腸桿菌、糞腸球菌的摻入, 肺炎克雷伯菌降低了整體生物膜厚度(圖 S1G)。 我們設計了一個菌落形成單位 (cfu) 檢測作為 存在活細菌和白色念珠菌細胞的讀數和 發現細菌和白色念珠菌都被摻入 隨著時間的推移進入生物膜(圖 2A-2D 和 S2A-S2C)。
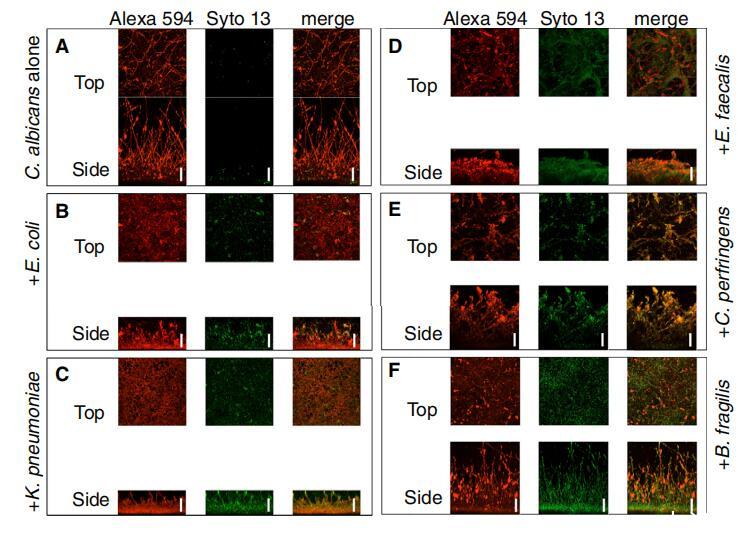
圖 1. 白色念珠菌與五個形成生物膜 體外不同種類的細菌 (A-F)白色念珠菌在生物膜中生長 24 小時 單獨使用 (A) 或與大腸桿菌 (B)、肺炎克雷伯菌一起使用 (C)、糞腸球菌 (D)、產氣莢膜梭菌 (E) 或脆弱擬桿菌 (F)。 生物膜用伴刀豆球蛋白 A 染色, Alexa 594 和 Syto 13 染料,然后由 中海法會。 圖像是最大強度投影 的頂視圖和側視圖。 代表圖像 至少顯示三個重復。 比例尺 代表 50 毫米。 另請參見圖 S1。
C. perfringes 和 B. fragilis 在共培養中增殖 在環境含氧條件下具有白色念珠菌的生物膜
白色念珠菌和/或產氣莢膜梭菌或脆弱芽孢桿菌細胞在生物膜中共培養 4、24、48 或 72 小時,在環境有氧或 缺氧條件。 每個物種隨時間的增長是 通過電鍍測量 cfu(圖 2A-2D)。 堅持 并且白色念珠菌的生長不受存在或 沒有細菌細胞; 然而,最初的堅持 C. perfringens 和 B. fragilis 在存在時增加了 10 倍 白色念珠菌。 在混合生物膜中,粘附后,產氣莢膜梭菌 顯示出大幅增長,從 w5 3 105 cfu/ml 到 w1 3 107 cfu/ml 在 24 小時內,無論生物膜是在環境有氧還是缺氧條件下生長(圖 2A 和 2C)。 沒有白色念珠菌,存活的產氣莢膜梭菌細胞減少 在環境含氧條件下 24 小時后低于檢測值 (<10 cfu/ml)(圖 2A)。 B. fragilis 表現出同樣的趨勢(圖 2B 和 2D)。 除了標準實驗室菌株 白色念珠菌 (SC5314),我們測試了另外兩種臨床分離株 C. albicans 并發現他們也能夠支持 厭氧菌生長(圖 S2D 和 S2E)。 我們的數據證明 并入生長于下的白色念珠菌生物膜 環境好氧條件使厭氧菌生長 C. perfringens 和 B. fragilis; 沒有保護性生物膜, 這兩種細菌物種的生存能力迅速下降。
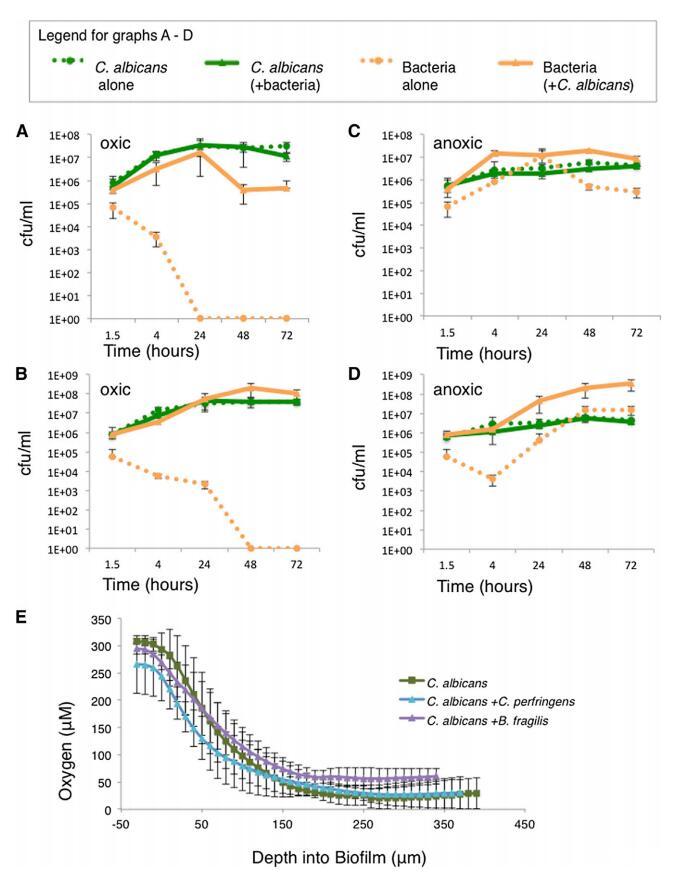
圖 2. 混合物種生物膜提供了一個 厭氧菌生長的利基 (A–D) 在生物培養基中生長的指定物種的 cfu/ml 單養或共養的薄膜在好氧或 缺氧條件。 細胞是從生物 僅薄膜(不是來自生物膜上方的介質) 在 1.5、4、24、48 和 72 小時并鍍上 cfu。 (A) C. albicans 和/或 C. perfringes in oxic 狀況。 (B) C. albicans 和/或 B. fragilis in oxic 狀況。 (C) 缺氧條件下的白色念珠菌和/或產氣莢膜梭菌 狀況。 (D) C. albicans 和/或 B. fragilis 在缺氧條件下。 (E) 在組成的生物膜中測量氧氣 使用 STOX 傳感器檢測指定物種。 從頂部每 10 毫米讀取一次讀數 到生物膜的底部。 對于所有圖形,至少兩次重復的平均值 顯示,誤差條顯示 SD。 也可以看看 圖 S2。
白色念珠菌生物膜創造缺氧微環境 檢驗生物膜造成局部缺氧的假設 使厭氧菌生長的環境, 我們使用小型化的、 可切換的微量氧 (STOX) 傳感器,一種能夠 測量氧濃度低至 10 nM [13]。 使用 STOX 傳感器的測量結果顯示氧氣梯度 整個生物膜深度的濃度,降低 從靠近生物膜頂部的 w300 mM(環境氧)到 底部附近小于 50 mM(圖 2E)。 氧氣 無論是否生長白色念珠菌,梯度都保持不變 在單一栽培中或與產氣莢膜梭菌共培養或 B. 脆弱的。
生物膜與細菌共培養改變基因表達 在白色念珠菌中
確定白色念珠菌是否對細菌有反應 在混合物種生物膜中,我們通過微陣列測量了白色念珠菌的基因表達變化(圖 3A;數據集 S1)。 相對于在不存在的情況下形成的白色念珠菌生物膜 細菌,許多基因被上調和下調 在細菌存在的情況下。 一些基因改變了表達 響應所有的細菌種類,而其他的則是 特定于少數物種。
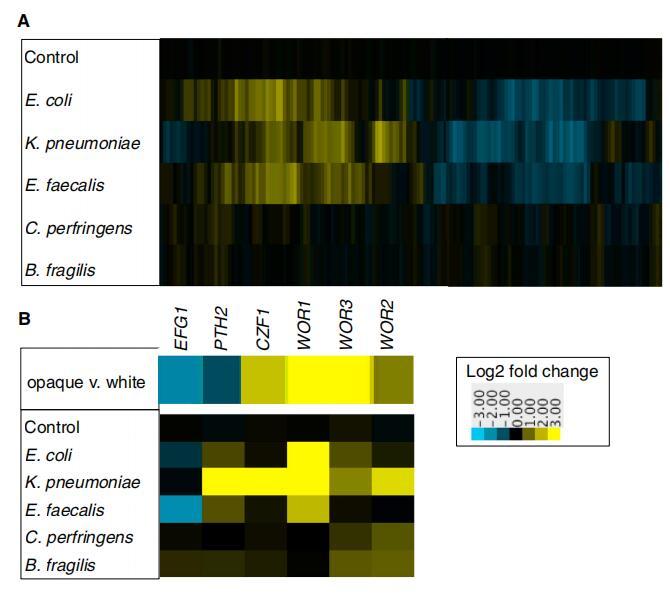
圖 3. 與生物膜中的細菌共培養誘導白色念珠菌中的差異基因表達 (A) 白色念珠菌基因表達的熱圖 當與指定物種共培養時 生物膜,與單獨的白色念珠菌相比。 顯示 是至少兩個生物學的中值 復制。 對照是指白色念珠菌,添加培養基以模擬細菌接種物, 與單獨的白色念珠菌相比。 沿顯示 x 軸是 2,863 個差異基因 在至少一種條件下調節至少 2 倍。 上調基因是黃色的; 下調 基因是藍色的。 (B) 編碼基因的基因表達模式 控制白色透明開關電路的轉錄調節器。 頂部面板顯示 在不透明與 [14] 中的白細胞。 底部面板顯示 白色念珠菌共培養時的表達水平 在具有指定細菌種類的生物膜中, 與單獨的白色念珠菌相比。 另請參見圖 S3。
差異最大的基因是那些 編碼控制白色透明開關的轉錄調節因子。白色念珠菌,兩個細胞之間的過渡 類型,每種類型都可以遺傳多代 [15-18](圖 3B)。 特別是 WOR1,它對“主”進行編碼 白色不透明轉換的調節器,被強烈上調 通過與肺炎克雷伯菌、大腸桿菌和糞腸球菌共培養。 與肺炎克雷伯菌共培養也誘導了幾個 其他已知的轉錄調節因子在 白色不透明開關,以獨立于 WOR1 的方式(圖 S3;數據集 S2)[14, 17, 19-21]。
盡管許多不透明特異性基因被上調,但完整的不透明特異性基因表達模式是 沒有觀察到,當從這種情況中移除時, 白色念珠菌細胞恢復為“經典”白細胞。 我們建議 與細菌細胞共培養使 C. albicans 轉變為 從白色到不透明,但需要額外的信號 用于完全切換。
C. 產氣莢膜受聚集保護并誘導聚集 懸浮培養中的白色念珠菌
進一步探索白色念珠菌與 細菌微生物組成員,我們將它們在懸浮培養物中共培養,并觀察到一些細菌 誘導與白色念珠菌細胞的共聚集(表 S1;圖 4A-4D)。 最顯著的效果發生在產氣莢膜梭菌 在環境有氧條件下。 光學顯微鏡顯示, 產氣莢膜梭菌誘導的聚集體由 含有白色念珠菌和產氣莢膜念珠菌的致密團塊 細胞和類似微型生物膜(圖 4G)。 通過監測懸浮培養中生長的產氣莢膜梭菌的 cfu/ml 隨著時間的推移(圖 4H 和 4I),我們觀察到 白色念珠菌的數量使產氣莢膜梭菌在含氧懸浮液條件下存活至 w1 3 106 cfu/ml 的水平; 在沒有白色念珠菌的情況下,產氣莢膜念珠菌的 cfu 下降 至少五個數量級,達到檢測不到的水平 (<10 cfu/ml),24 小時 (圖 4H)。
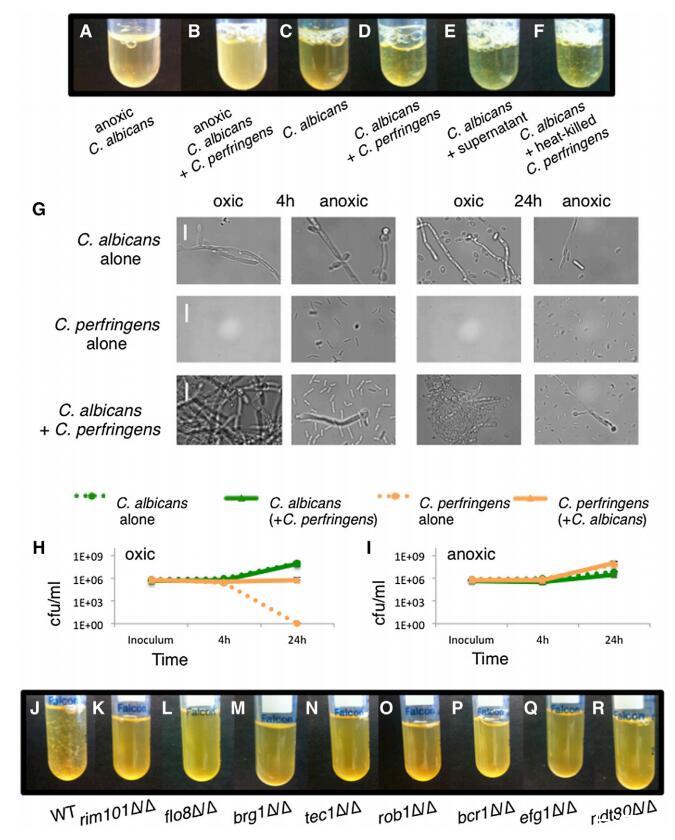
圖 4. 產氣莢膜梭菌誘導聚集 環境含氧、懸浮期間的白色念珠菌 共培養 白色念珠菌懸浮培養物或 不含產氣莢膜梭菌,生長 4 小時或 24 小時 在 37 度,在缺氧或環境有氧條件下。 (A-F) 4 小時生長。 (A) 單獨的白色念珠菌,缺氧。 (B) 白色念珠菌 + 產氣莢膜念珠菌,缺氧。 (C) 單獨的白色念珠菌,好氧。 (D) 白色念珠菌 + 產氣莢膜梭菌,好氧。 (E) 白色念珠菌 + 無細胞上清液 C.產氣莢膜培養。 (F) 白色念珠菌 + 熱殺死的產氣莢膜念珠菌細胞。 (G) 白色念珠菌和/或產氣莢膜念珠菌的成像 光學顯微鏡。 代表性圖像是 顯示。 比例尺代表 20 毫米。 (H 和 I) cfu/ml 中生長的指定物種 單一培養或共培養,懸浮培養 在環境有氧或缺氧條件下。 (H) 環境中的白色念珠菌和/或產氣莢膜念珠菌 好氧條件。 (I) 缺氧條件下的白色念珠菌和/或產氣莢膜梭菌 狀況。 顯示的是至少兩個的平均值 復制品; 誤差條顯示 SD。 (J–R) C. albicans 野生型或突變株 懸浮生長,在環境氧氣中,對于 4 小時與產氣莢膜梭菌。 (J) 重量級。 (K) rim101D/D。 (L) flo8DD/D。 (M) brg1D/D。 (N) tec1D/D。 (O) rob1D/D。 (P) bcr1D/D。 (Q) efg1D/D。 (R) ndt80D/D。 對每種條件或突變株至少進行兩次測定。 另請參見圖 S4。
雖然微型生物膜太 小到直接探測氧氣濃度,我們注意到白色念珠菌 這些條件下的基因表達 基因顯著富集 在缺氧條件下調節 (p = 1.4 3 1025 ) [22](圖 S4A;數據 設置 S3),表明微型生物膜與傳統的一樣, 表面粘附的生物膜,提供低氧環境。 與這個想法一致,我們發現產氣莢膜梭菌細胞 還刺激常規早期階段的聚集 固體表面上的白色念珠菌生物膜形成(圖 S4B)。
我們用無細胞重復懸浮生長實驗 上清液或熱滅活的產氣莢膜梭菌細胞并觀察 兩者都能夠誘導白色念珠菌的聚集(圖 4E 和 4F)。 我們盲目篩選了205個缺失菌株的文庫 在白色念珠菌中 [23](表 S2)并確定了八個轉錄 調節器編碼基因和觀察到的種間聚集所需的其他兩個基因(圖 4K- 4R 和 S4C)。 值得注意的是,六個轉錄調節因子 (Brg1、Tec1、Rob1、Bcr1、Ndt80 和 Efg1)在我們的屏幕中找到 之前確定的常規監管機構 生物膜形成 [12],提供了強有力的證據,證明產氣莢膜梭菌通過生物膜遺傳程序誘導聚集體形成。 其他兩個缺乏聚集的調節突變體 是 rim101D/D 和 flo8D/D,尚未報告給 是常規生物膜形成所必需的。 DEF1,即 對菌絲擴展很重要 [24] 和 ALS3,它編碼 一種對生物膜形成很重要并在與許多細菌物種相互作用中發揮作用的粘附素 [25-29],也是 聚合所需(圖S4C)。 如補充實驗程序中所述,我們量化了聚合 使用沉降測定并驗證刪除 菌株由基因“add-backs”補充(圖 S4D 和 S4E)。
這些結果支持一個模型,即在環境好氧條件下 懸浮培養,產氣莢膜梭菌誘導白色念珠菌 形成保護性聚集體,這取決于白色念珠菌 生物膜遺傳程序。 這些微型生物膜,其中含有 白色念珠菌和產氣莢膜梭菌,允許產氣莢膜梭菌 在通常有毒的含氧條件下存活。
厭氧細菌和白色念珠菌一起生物膜內生長和在懸浮培養中誘導生物膜的形成——概括、結果
 相關新聞
相關新聞