熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
腸道內(nèi)的微生物可以塑造全身免疫并影響全身水平的健康和疾病(包括癌癥)狀態(tài)。從健康到炎癥到早癌再到癌癥,全身和局部免疫及炎癥狀況、腸道微生物組以及組織中微生物的狀況都有巨大差異。
改善飲食,仍是目前最安全、成本效益高且易于獲得的干預(yù)方式。有證據(jù)表明在開(kāi)始飲食干預(yù)后5天內(nèi),腸道微生物就會(huì)發(fā)生顯著變化。
說(shuō)到腸道菌群,你能想到的可能主要就是促進(jìn)消化,但是近年來(lái)隨著科學(xué)研究的不斷深入,科學(xué)家們逐漸發(fā)現(xiàn),腸道菌群遠(yuǎn)沒(méi)有想象中的那么簡(jiǎn)單。
微生物——這一35億年前就出現(xiàn)的古老生物群,自人類誕生之初就在人類的消化道與人類處于進(jìn)化共生關(guān)系。腸道的微生物組(gut microbiome,GM)實(shí)際上包含的不僅僅有細(xì)菌,還包括了病毒、真菌、酵母菌、原蟲(chóng)等等,人體中的腸道微生物可以多達(dá)100萬(wàn)億個(gè),它們左右著我們的健康,影響了我們?cè)S多生理過(guò)程包括消化、新陳代謝、認(rèn)知以及免疫系統(tǒng)的發(fā)育和功能。有時(shí)甚至?xí)绊懓┌Y的發(fā)生。
腸道微生物與癌癥
近年來(lái),有多種細(xì)菌被發(fā)現(xiàn)通過(guò)危害腸道微生物生態(tài)進(jìn)而促進(jìn)大腸癌的發(fā)病。這些菌種包括但不限于具核梭桿菌、解沒(méi)食子酸鏈球菌、脆弱擬桿菌的腸毒性菌株,聚酮合成酶陽(yáng)性(PKS+ve)的大腸桿菌菌株,糞腸球菌和厭氧消化鏈球菌。它們與腫瘤增殖有關(guān),誘導(dǎo)促炎狀態(tài)和逃避抗腫瘤免疫。
講到腸道微生物群對(duì)癌癥的影響,大部分人的印象可能是某些有害的腸道細(xì)菌產(chǎn)生了毒素進(jìn)而促進(jìn)了腸癌的逐步發(fā)生。事實(shí)上腸道內(nèi)的微生物會(huì)通過(guò)幾種標(biāo)志性機(jī)制影響宿主免疫和對(duì)癌癥治療的反應(yīng)。包括:(1)對(duì)腸道中其他微生物的影響,導(dǎo)致生態(tài)系統(tǒng)發(fā)生變化;(2)對(duì)腸壁的影響,包括腸細(xì)胞(誘導(dǎo)自噬和細(xì)胞凋亡)和腸道相關(guān)淋巴組織;(3)感知輔助信號(hào)的模式識(shí)別受體的局部或全身刺激;(4)通過(guò)腸道激素分泌產(chǎn)生全身神經(jīng)內(nèi)分泌作用;(5)通過(guò)多胺和B族維生素合成產(chǎn)生全身代謝作用;(6)誘導(dǎo)針對(duì)與腫瘤相關(guān)抗原交叉反應(yīng)的微生物抗原的免疫反應(yīng)。
其中最為人熟知的是具核梭桿菌。具核梭桿菌本身是一種定植于口腔中的細(xì)菌。原本從口腔到腸道,物理距離非常遠(yuǎn),路途中又有胃酸和膽汁作為化學(xué)障礙,形成口腔—腸道屏障。但是因?yàn)槟承┰颍热缥杆峤档停尶谇晃⑸锶捍罅哭D(zhuǎn)移到了腸道。與健康人相比,結(jié)直腸癌患者的腫瘤組織和糞便中普遍存在具核梭桿菌的細(xì)胞核。體外試驗(yàn)和小鼠模型都揭示了具核梭桿菌促進(jìn)結(jié)直腸癌細(xì)胞增殖的作用;具核梭桿菌還可以通過(guò)另一種粘附素Fap2與抑制性免疫受體TIGIT結(jié)合來(lái)抑制腫瘤浸潤(rùn)淋巴細(xì)胞和自然殺傷(NK)細(xì)胞的細(xì)胞毒性功能,從而抑制免疫監(jiān)視;甚至還能在促進(jìn)腫瘤對(duì)化療耐藥性方面發(fā)揮作用,一項(xiàng)大型隊(duì)列研究表明,具核梭桿菌的豐度與總生存期(OS)降低有關(guān)。
而不同年齡的散發(fā)性大腸癌,其腸道微生物組的特征也可能有所差異。近期復(fù)旦大學(xué)附屬腫瘤醫(yī)院的馬延磊教授領(lǐng)銜團(tuán)隊(duì)在國(guó)際胃腸肝病學(xué)界頂級(jí)雜志《Gut》上發(fā)表的最新研究,首次揭示了發(fā)病年齡小于50歲的青年腸癌(早發(fā)性腸癌)與發(fā)病年齡大于50歲的老年腸癌(遲發(fā)性腸癌),在腸道菌群譜、代謝譜、細(xì)菌酶基因譜改變等方面存在顯著差異。青年腸癌多組學(xué)特征主要表現(xiàn)為致病菌普氏梭桿菌富集、紅肉飲食相關(guān)細(xì)菌富集以及色氨酸、膽汁酸和膽堿代謝的增加;由紅肉飲食相關(guān)菌、膽堿代謝物和細(xì)菌膽堿代謝酶構(gòu)成的反應(yīng)途徑激活,可能是青年腸癌發(fā)病的潛在干預(yù)靶點(diǎn)。另一方面,老年腸癌的特征則表現(xiàn)為具核梭桿菌富集、短鏈脂肪酸過(guò)度消耗、乙酸/乙醛代謝向乙酰輔酶A代謝轉(zhuǎn)變。
腸道內(nèi)的微生物可以塑造全身免疫并影響全身水平的健康和疾病(包括癌癥)狀態(tài)。從健康到炎癥到早癌再到癌癥,不同健康狀況下,全身和局部免疫及炎癥狀況、腸道微生物組以及組織中微生物的狀況都有巨大差異。這是由全身免疫成分與炎癥標(biāo)志物、組織免疫和腫瘤免疫以及腸道和腫瘤微生物群之間的動(dòng)態(tài)相互作用介導(dǎo)的。健康人群全身和組織免疫功能良好,系統(tǒng)炎癥狀態(tài)最低,腸道微生物組的多樣性和功能豐富,組織上的微生物組密度較低而且都是非致病性的;而到了進(jìn)展期癌癥則與之截然相反,免疫功能低下,腸道微生物組多樣性和功能均非常差,腸道和組織都出現(xiàn)了大量的致病微生物。
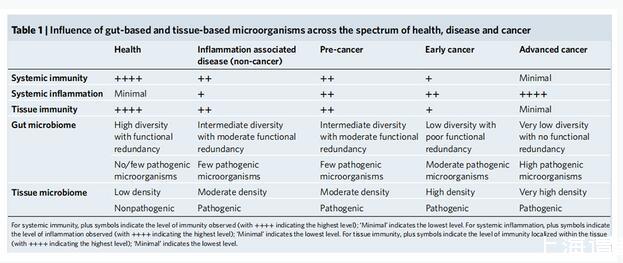
不同健康狀況下腸道與組織中微生物的影響。來(lái)源:PARK E M,CHELVANAMBI M,BHUTIANI N,et al.Targeting the gut and tumor microbiota in cancer[J].Nature Medicine,2022,28(4):690-703.
組織駐留和腫瘤內(nèi)微生物——是敵還是友?
除了腸道以外,其他生態(tài)部位的微生物也會(huì)對(duì)宿主的生理產(chǎn)生影響。腫瘤微環(huán)境(TME)是微生物生長(zhǎng)的一個(gè)有吸引力的生態(tài)環(huán)境。一個(gè)多世紀(jì)以來(lái),已經(jīng)在癌癥患者的腫瘤中發(fā)現(xiàn)了微生物,現(xiàn)在,新一代測(cè)序(NGS)技術(shù)的進(jìn)步使人們對(duì)實(shí)體惡性腫瘤中腫瘤內(nèi)微生物組的局部多樣性和功能相關(guān)性有了更多的了解。然而,微生物在腫瘤當(dāng)中發(fā)揮著什么樣的作用仍無(wú)法完全確定,因?yàn)槟承┪⑸锼坪醮龠M(jìn)了腫瘤發(fā)生,而另一些微生物則通過(guò)充當(dāng)免疫佐劑來(lái)幫助抗腫瘤免疫反應(yīng)。
為什么機(jī)體的組織和腫瘤當(dāng)中會(huì)發(fā)現(xiàn)有微生物呢?事實(shí)上,腫瘤和癌前病變是特別適宜微生物定植和持續(xù)存在的環(huán)境。快速血管生成和腫瘤壞死有助于形成高度缺氧和營(yíng)養(yǎng)豐富的腫瘤微環(huán)境,該微環(huán)境可以支持兼性和/或厭氧細(xì)菌菌株的定植。這些微生物可以通過(guò)多種機(jī)制影響癌癥的發(fā)展、進(jìn)展、治療反應(yīng)和抗腫瘤免疫。首先,組織駐留的微生物可以通過(guò)改變宿主基因組的各個(gè)方面來(lái)促進(jìn)腫瘤發(fā)生。其次,組織駐留的微生物可以通過(guò)在組織內(nèi)誘導(dǎo)促腫瘤炎癥環(huán)境來(lái)促進(jìn)腫瘤形成。最后,微生物代謝的副產(chǎn)品也可能導(dǎo)致致癌。次級(jí)代謝物,如次級(jí)膽汁酸:石膽酸和脫氧膽酸及其分解代謝物,如乙酸和丁酸,在幾種癌癥模型中均通過(guò)增強(qiáng)上皮—間質(zhì)轉(zhuǎn)化或細(xì)胞增殖而發(fā)揮致癌作用。脫氧膽酸與結(jié)直腸癌、肝細(xì)胞癌和食道癌有關(guān),在高脂飲食時(shí)產(chǎn)生的水平增加,這進(jìn)一步為某些高風(fēng)險(xiǎn)飲食與癌癥發(fā)展的關(guān)聯(lián)提供了機(jī)制基礎(chǔ)。
另一方面,瘤內(nèi)微生物也可能支持抗腫瘤免疫。在不同情況下,瘤內(nèi)微生物相關(guān)分子模式(microorganism-associated molecular patterns,MAMPs)對(duì)腫瘤內(nèi)一些信號(hào)通路的激活已經(jīng)被證實(shí)對(duì)腫瘤病變具有免疫監(jiān)視增強(qiáng)的作用。
因此是敵還是友?可能還是需要根據(jù)具體的環(huán)境進(jìn)行分析。
我們?cè)撛趺崔k?
無(wú)論是健康人群還是已經(jīng)得病的患者,其實(shí)最關(guān)心的是我們?cè)撊绾巫鰜?lái)改善腸道菌群。人們總是想著“吃一些”什么來(lái)實(shí)現(xiàn)改變,如服用傳統(tǒng)的益生菌。這些益生菌通常來(lái)自一個(gè)狹窄的屬,主要包括乳桿菌和雙歧桿菌,但是臨床證據(jù)似乎提示服用這些益生菌并未帶來(lái)任何顯著的健康益處,尤其是在健康個(gè)體中。
因此,改善飲食,仍是目前最安全、成本效益高且易于獲得的干預(yù)方式。飲食的改變可以改變腸道微生物組的組成,有證據(jù)表明在開(kāi)始飲食干預(yù)后5天內(nèi),腸道微生物就會(huì)發(fā)生顯著變化。盡管我們攝入的所有東西都有可能改變我們腸道微生物組的組成,但科學(xué)家們更多地將注意力集中在關(guān)于膳食纖維、益生元、多酚、發(fā)酵食品、動(dòng)物肉類及甜味劑和防腐劑。
常識(shí)告訴我們,膳食纖維、益生元、多酚這類食物通常是“對(duì)身體好的”,而多吃動(dòng)物肉類、甜味劑和防腐劑“對(duì)身體不好”。事實(shí)上,腸道微生物組的許多研究進(jìn)展也給這些“常識(shí)”提供了大量的佐證。
膳食纖維是一種多糖,既不被胃腸道消化吸收,也不產(chǎn)生能量,但是腸道微生物組會(huì)作用于膳食纖維,促進(jìn)代謝,如短鏈脂肪酸。過(guò)低的膳食纖維攝入會(huì)導(dǎo)致脂肪酸的生產(chǎn)減少,進(jìn)而讓腸道微生物組轉(zhuǎn)而使用其他營(yíng)養(yǎng)物質(zhì),從而產(chǎn)生可能對(duì)腸道有害的代謝產(chǎn)物。美國(guó)腸道計(jì)劃推薦人們每周食用超過(guò)30種的植物,才能保證擁有最健康、最多樣的腸道菌群。
多酚是含有一個(gè)以上酚羥基的化合物,是植物化學(xué)物質(zhì)中最大的一類。它們大量存在于各種各樣的食物中,例如五顏六色的水果、蔬菜、藥草、種子、谷物、咖啡、茶、可可和葡萄酒中。酚類化合物及其代謝物被認(rèn)為通過(guò)調(diào)節(jié)腸道微生物平衡并同時(shí)抑制病原體而有助于有益的胃腸道健康。有研究發(fā)現(xiàn),食用從可可提取出的多酚物質(zhì)與血漿高密度脂蛋白升高以及甘油三酯和C反應(yīng)蛋白的降低有關(guān),也有研究注意到在食用水果、種子、紅酒和茶多酚之后致病性的梭菌數(shù)有所降低。
現(xiàn)在已經(jīng)證實(shí)了每天每多攝入100g紅肉或者50g加工肉,腸癌風(fēng)險(xiǎn)就會(huì)增加15—20%。食用植物蛋白會(huì)增加腸道短鏈脂肪酸水平,進(jìn)而促進(jìn)腸道微生物組向好的方向發(fā)展,而隨著動(dòng)物肉類的食用增加,研究也發(fā)現(xiàn)耐膽汁的厭氧菌如擬桿菌、另枝菌和嗜膽菌增加,進(jìn)而讓腸道微生物組向著不好的方向發(fā)展。
甜味劑的使用目前已經(jīng)非常廣泛,能夠作為糖的替代品又不會(huì)提供過(guò)多卡路里,目前甜味劑普遍被認(rèn)為是安全的。但是也有一些動(dòng)物實(shí)驗(yàn)發(fā)現(xiàn)甜味劑表現(xiàn)出了微生物組擾動(dòng)和葡萄糖耐受不良。三氯蔗糖、阿斯巴甜和糖精已被證明會(huì)破壞人類和動(dòng)物模型中的微生物組平衡和多樣性;食品中常用的乳化劑,也在一些動(dòng)物模型中被發(fā)現(xiàn)影響了腸道菌群的多樣性,導(dǎo)致擬桿菌和疣微菌減少,促炎變形菌增多。
對(duì)于腸道微生物組及其對(duì)腫瘤的影響,科學(xué)家的探索才剛剛起步,隨著新技術(shù)的應(yīng)用以及更加深入的研究,科學(xué)家們一定會(huì)通過(guò)腸道微生物組,進(jìn)一步優(yōu)化目前腫瘤的預(yù)防和治療的策略,讓人們真正從科學(xué)研究的碩果中獲益。
(作者周昌明,系復(fù)旦大學(xué)附屬腫瘤醫(yī)院腫瘤預(yù)防部公共衛(wèi)生主管醫(yī)師,流行病學(xué)博士)
參考文獻(xiàn):
[1]KONG C,LIANG L,LIU G,et al.Integrated metagenomic and metabolomic analysis reveals distinct gut-microbiome-derived phenotypes in early-onset colorectal cancer[J].Gut,2022:2022-327156.
[2]PARK E M,CHELVANAMBI M,BHUTIANI N,et al.Targeting the gut and tumor microbiota in cancer[J].Nature Medicine,2022,28(4):690-703.
[3]SI H,YANG Q,HU H,et al.Colorectal cancer occurrence and treatment based on changes in intestinal flora[J].Seminars in Cancer Biology,2021,70:3-10.
[4]INAMURA K.Gut microbiota contributes towards immunomodulation against cancer:New frontiers in precision cancer therapeutics[J].Seminars in Cancer Biology,2021,70:11-23.
[5]LEE K A,LUONG M K,SHAW H,et al.The gut microbiome:what the oncologist ought to know[J].Br J Cancer,2021,125(9):1197-1209.
[6]PARK S,HWANG B,LIM M,et al.Oral–Gut Microbiome Axis in Gastrointestinal Disease and Cancer[J].Cancers,2021,13(9):2124.
 相關(guān)新聞
相關(guān)新聞