熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
太陽能分解水制氫有三種典型的技術路線,分別為光伏輔助電解水、光催化分解水和光電催化分解水。利用粉末光催化劑實現太陽能分解水制氫是上述三種技術路線中最簡單、最經濟的,裝置搭建更為容易,整體廉價、易大規模化。自1972年Honda和Fujishima報道了在TiO2電極上觀察到光照促進水分解現象以來,世界各國科學家在利用太陽能光催化分解水制氫這一領域做了大量研究,取得了系列重要研究進展。
1、半導體光催化制氫原理
利用半導體光催化分解水制氫則可以在室溫下進行,其基本原理為半導體通過吸收太陽光實現電子從基態躍遷至激發態并產生足夠能量的導帶電子和價帶空穴以滿足水分解的熱力學要求。
半導體是一類導電性(常溫下)介于金屬與絕緣體的材料,由于其特殊的能帶結構及良好的光穩定性成為光催化分解水制氫的優選材料。根據能帶理論,半導體的價帶為“滿帶”,完全被電子占據;導帶為“空帶”,沒有電子占據。如圖1所示,半導體價帶頂與導帶底的能量差稱為“帶隙”,當半導體吸收能量等于或大于其帶隙的光子時,電子將從價帶(VB)激發到導帶(CB),生成電子(e-),在VB中留下空穴(h+)。由于半導體能帶的不連續性,電子或空穴在電場作用下或通過擴散的方式運動,當彼此分離后遷移到半導體的表面,與吸附在表面的物質發生氧化還原反應,或者被體相或表面的缺陷捕獲,也可能直接復合、以光或熱輻射的形式轉化。光激發產生的電子-空穴對具有一定的還原和氧化能力,由其驅動的反應稱為光催化反應。
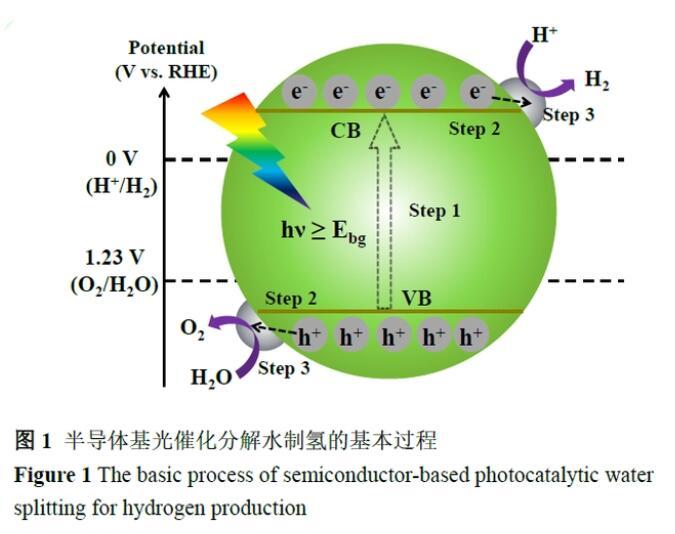
根據激發態的電子轉移和熱力學的限制,光催化分解水制氫要求半導體的導帶底能級比質子還原電位更負(H+/H2;0-0.059 pH,V vs.RHE(標準氫電極)),而價帶頂能級比水的氧化電位更正(H2O/O2;1.23-0.059 pH,V vs.RHE)。從理論上講,驅動全分解水反應所需的最小光子能量為1.23 eV,對應波長約為1000 nm左右的光子。但實際上,由于半導體能帶彎曲的影響和水分解過電位的存在,對半導體帶隙的要求往往大于理論值,一般認為應大于1.8eV。一般來說,光催化分解水反應包括光催化還原反應和光催化氧化反應。在光催化還原反應中光生電子還原電子受體H+,相應的氧化反應為空穴氧化電子給體H2O,整體的反應速率由速率較慢的反應決定。就熱力學而言,光催化水氧化反應是熱力學爬坡的反應(ΔGθ為237 kJ/mol),同時涉及4個電子的轉移過程,而光催化水還原反應只需2個電子參與且ΔGθ接近于零,因此光催化氧化反應通常被認為是水分解反應的速控步驟。
根據光催化分解水反應機理,半導體光催化主要涉及三個過程:1)光吸收與激發,2)光生電子和空穴的分離與轉移,3)表面催化反應。若將每一步的效率分別表示為η捕光、η分離、η反應,太陽能到氫能的轉化效率直接由光吸收效率、電荷分離效率和表面催化反應效率的乘積決定(η轉化=η捕光*η分離*η反應),因此只有當三個過程同時高效進行才能獲得較高的太陽能到氫能轉化效率。此外,這三個過程并不是互相獨立的,而是相互作用、互相影響的,例如吸收帶邊紅移(即:帶隙變小)可提升捕光效率,但帶隙變小導致光生載流子遷移驅動力變小,致使光生電荷分離變得更加困難,即難于獲得高效電荷分離效率。
2、光催化活性評價體系
由于空氣中存在大量的氧氣,考慮到氧氣的檢測對評價光催化反應十分重要,因此在測試光催化反應過程中一定要避免空氣干擾。常用于測試光催化活性的裝置可分為兩種,一種是閉路循環系統(圖2),在該系統中,光催化劑分散在反應器的溶液中,整個反應系統被抽真空以消除空氣的影響,待空氣清除完成后,光源(如高/中/低壓汞燈、氙燈、鹵素燈、LED燈、發光二極管等)從頂部、側部或內部照射;另一種是開放流動系統,惰性氣體連續地流過反應體系將生成的氣體一起帶入到檢測器中。用于光催化反應性能評價的反應器系統應安裝冷卻循環水確保反應在室溫下進行,以避免可能發生的熱催化過程或熱效應對反應性能的影響,具體原因如下所述。
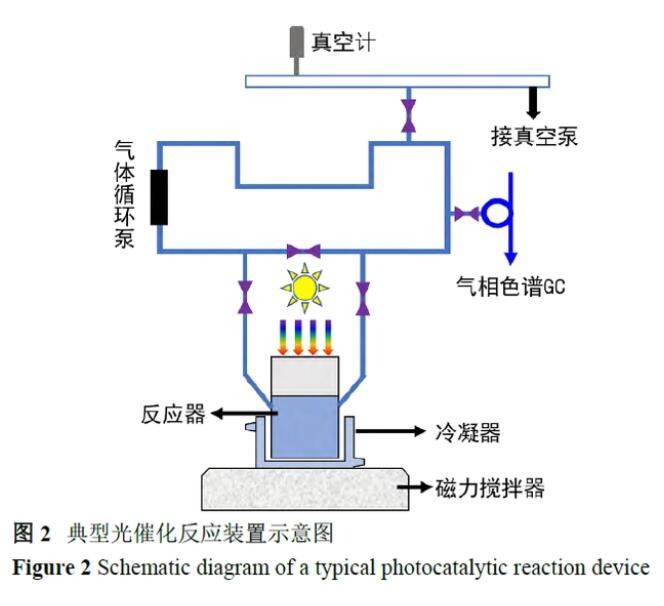
光誘發的化學反應主要包括以下幾種類型:(1)由光激發產生光生載流子引起“真正”的光催化過程,即稱為本文中的“光催化”;(2)催化劑吸收光產生局部的熱,由熱引發的催化過程,即“光誘導熱催化”;(3)反應體系中既存在光催化又存在光誘導的熱作用,而且兩者之間還產生協同效應,則通常稱之為“光熱催化”。在光催化過程中參與反應的是激發態的電子和空穴,具有一定的氧化/還原能力可以實現室溫下熱力學不可自發進行的反應;而光誘導的熱催化中參與反應的是基態的電子,與傳統的熱催化具有相同的本質屬性,即:可以改變反應路徑、降低活化能,進而加快反應速度,但反應發生的前提必須是溫度足夠高致使該反應熱力學可行。由此可見,光催化是利用激發態的載流子驅動反應,所用的催化材料則要求一定為半導體,而光誘導的熱催化則利用基態電子參與反應,因而所用催化材料的種類不局限于半導體,吸光熱效應強的材料均可為潛力材料。兩者之間的本質差異在于光催化主要致力于在室溫下驅動熱力學不能自發的反應,避免傳統高溫高壓熱催化對材料、設備等苛刻要求,而光誘導熱催化本質上就是熱催化,只是輸入的熱量來自于光的吸收,因此其活性高低應該與傳統熱催化進行對比而不是光催化。
3、光催化分解水制氫催化劑的組成
半導體光催化分解水制氫體系通常由兩部分組成:一部分是半導體,一部分是助催化劑。半導體主要負責光吸收、激發以及光生載流子的遷移;助催化劑主要負責富集轉移到其表面的電荷,同時也可降低反應的活化能,加快反應的速率。一般當沒有助催化劑存在時,半導體自身的活性通常比較低,一方面緣于其自身有限的電荷分離能力,一方面因為分解水本身的活化能較高。由于半導體與助催化劑往往分別隸屬于不同的物相,因此其界面結構對光生電荷由半導體向助催化劑的傳輸具有重要影響,對光催化分解水制氫性能起關鍵作用。
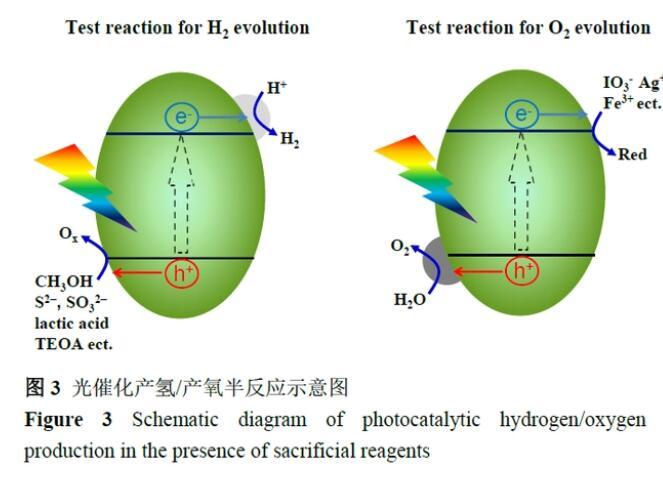
光催化全分解水要求半導體同時滿足質子還原和水氧化的電位需求,對半導體的導價帶位置要求較高,同時考慮到水分解反應為熱力學爬坡、動力學需多電子轉移的過程,因此實現全分解水制氫仍然十分具有挑戰。為了研究光催化劑分解水的潛力,有必要將全分解水拆解成兩個半反應:產氫半反應和產氧半反應,即將空穴犧牲試劑或電子犧牲試劑引入到體系中,快速消耗光激發的空穴和電子,避免因電荷累積而引起的復合。圖3描述了在犧牲試劑存在的情況下光催化半反應的基本原理,其中電子受體的標準電極電位比質子還原的電位更正,而電子供體的標準電極電位比水氧化的電位更負,從熱力學上犧牲試劑的反應相較于質子還原與水氧化更容易進行。在產氫半反應中,常用的空穴犧牲試劑為甲醇、SO32-/S2-、三乙醇胺和乳酸等;而對于產氧半反應,常用Ag+、Fe3+和IO3-等作為電子犧牲試劑。對于產氫和產氧半反應,相應的反應方式如下:
光催化產氫半反應:
2H++2 e→H2
Red+nh+→Ox(Red=電子供體)
光催化產氧半反應:
2H2O+4h+→4H++O2
Ox+ne→Red(Ox=電子受體)
4、光催化材料的發展
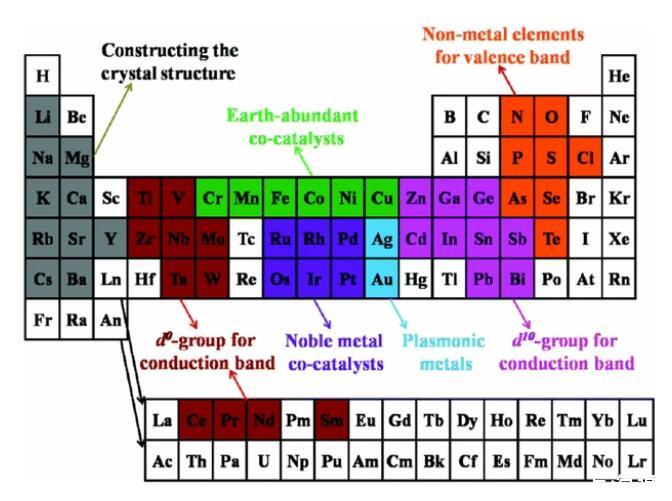
迄今為止,為了尋找制備簡單、高效穩定、環境友好的光催化劑,已經有成百上千種半導體被作為光催化劑,實現了紫外/可見光輻照下光催化分解水制氫/制氧。各種分解水半導體光催化劑的元素組成在元素周期表中顯示如下圖4所示。按照其元素組成可以分:單質光催化劑、金屬氧族化物光催化劑、金屬碳氮化物(MXenes)光催化劑、金屬有機框架化合物光催化劑、共價有機框架化合物光催化劑以及石墨相氮化碳光催化劑。
4.1單質光催化劑
由于單質半導體光催化劑B、C、P、S、Si和Se具有適中的禁帶寬度和適宜的能帶電位,因此被廣泛應用光催化分解水制氫制氧。構型為十二面體的B12團簇具有1.5-1.6 eV的禁帶寬度,能夠在可見光輻照下被激發生成OH自由基。對于碳單質及其衍生物而言,由于其缺乏足夠的禁帶寬度,因此不能單獨作為光催化劑使用。研究表明,元素摻雜和形貌控制可以拓寬碳材料的禁帶寬度,從而實現導體向半導體的轉變。在磷的三種同素異形體中,除了白磷不具有光催化活性外,黑磷和紅磷均可以作為分解水產氫光催化劑。但是,由于光生載流子復合嚴重,黑磷和紅磷的光催化表觀量子效率低于1%。通過將塊狀黑磷剝離成為少層或單層磷烯,成功實現了黑磷光催化活性的提高。Rahman等人通過微波輔助剝離的方式成功制備了少層黑磷,成功將黑磷在420nm單色輻照下的光催化產氫表觀量子效率提升至4%。這一結果為單質光催化劑的發展注入了一劑強心劑。在S的同素異形體中,正交晶系的S8單質被認為是在常溫常壓條件下最穩定的單質。Cheng等人發現正交晶系S8單質的禁帶寬度為2.4-2.8 eV,因此S8單質可以被用作可見光半導體光催化劑。然而由于其大顆粒的形貌和疏水的表面,導致了其絕對光活性低下,仍然需要進一步提高其光活性。
4.2金屬氧族化物光催化劑
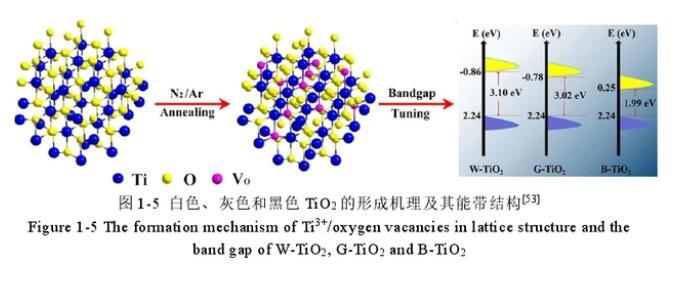
一般來說,金屬氧族半導體化合物按其組成可以分為金屬氧化物和金屬硫化物。常見的金屬氧化物半導體主要由過渡金屬元素與氧元素組成,如TiO2、ZnO、Cu2O和Fe2O3。按照其光吸收范圍,金屬氧化物半導體可以分為禁帶寬度大于3.0 eV的紫外光活性的光催化劑(如TiO2和ZnO)和禁帶寬度小于3.0 eV的紫外-可見光活性的光催化劑(如Cu2O和Fe2O3)。對于紫外光響應型半導體材料,盡管其在紫外光輻照下具有光催化活性,但其只能吸收占太陽光譜5%的紫外光,極大的限制了其應用。因此,目前針對TiO2和ZnO半導體材料的改性,主要是為了增加其在可見光范圍內的光吸收。理論上講,可以通過調變價帶頂電勢使其更負,或者調變導帶底電勢使其更正,或者在禁帶寬度中引入雜質能級,從而實現禁帶寬度的縮小,提高TiO2和ZnO半導體可見光利用率。例如,Du等人通過將白色的TiO2在不同的氣體氛圍中煅燒,成功制備出不同O空位濃度的TiO2。結果如下圖5所示,由于O空位的逐漸增大,使得TiO2的導帶位從-0.86 eV下移到-0.78 eV至0.25 eV,而價帶頂電勢不變,說明O空位越多TiO2禁帶寬度越小,從而增大了其在可見光范圍內的吸收,極大提高了TiO2的光催化NO移除活性。
對于可見光響應型半導體材料(如Cu2O和Fe2O3),盡管其具有可見光吸收,但是由于其易被氧化,穩定性較差,同時光生載流子復合嚴重,限制了其光催化活性的提高。考慮到Cu+和Fe2+容易被氧化成Cu2+和Fe3+,因此可以通過將價帶上具有強氧化性的空穴導離Cu2O和Fe2O3光催化劑表面,避免光催化劑本身被氧化。一方面不僅促進了光生電子-空穴的空間分離,另一方面也提高了Cu2O和Fe2O3的光穩定性,從而實現了光催化活性和光穩定性的雙重提高。
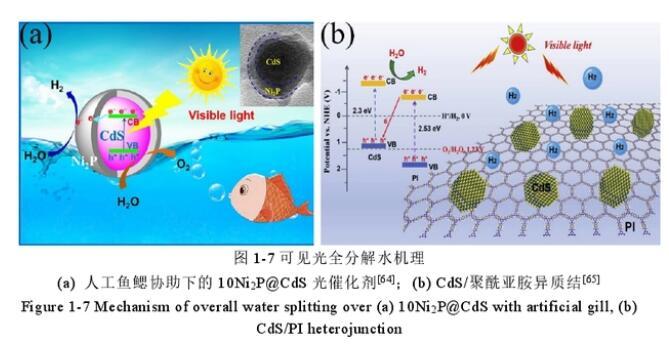
在金屬硫化物光催化劑中,導帶由過渡金屬d軌道組成,價帶則由S 3p軌道組成。由于S元素相比于O元素具有更小的電負性,因此含有同樣過渡金屬的金屬硫化價帶相比于金屬氧化物的價帶更負,導致了金屬硫化物的禁帶寬度小于其金屬氧化物的禁帶寬度,因此金屬硫化物相比于金屬氧化物具有更寬的光吸收范圍。盡管金屬硫化物滿足可見光分解水制氫的熱力學條件,但是由于其S2-陰離子容易被光氧化,導致了金屬硫化物光穩定性較差,制約了其實際應用。目前,ZnS、CdS和MoS2等金屬硫化物廣泛受到研究。其中,雖然ZnS能夠被用于光催化分解水制氫,但是其較大的禁帶寬度(3.66 eV)決定了其只能吸收紫外光。通過與其他同構的寬光譜吸收的金屬硫化物形成固溶體,可以有效的拓展ZnS光吸收范圍,從而達到提升其光催化活性的目的。當前金屬硫化物的研究主要集中在提高其抗光腐蝕和循環穩定性。例如,Lu等人通過在CdS光催化反應體系中加入人工魚鰓(圖6所示),對光催化反應過程中分解水產生的O2進行了消耗,從而避免了CdS被氧化,增強了其抗光腐蝕能力和光穩定性。同時由于Ni2P作為光催化分解水產氫助催化劑的加入,促進了光生載流子的分離,使得10Ni2P CdS在430 nm單色光輻照下,實現了3.89%的光催化全解水表觀量子效率。Wang等人通過構建CdS/聚酰亞胺Z型異質結(如圖6所示),將CdS價帶上的空穴成功中和,避免了S2-陰離子被空穴氧化,從而大幅提高了CdS/聚酰亞胺異質結材料的光穩定性。
4.3 MXenes光催化劑
MXenes指的是二維過渡金屬氮化物、碳化物或碳氮化物,其基本組成結構為Mn+1Xn Tx,M為過渡金屬Ti、Ta和Nb等,X為C或/和N,Tx為表面官能團–O,–F和–OH。由于其具有組成可調、大比表面積、大量的表面端基和良好的光電特性等優點,已經在光催化領域受到廣泛研究。自Ti3C2在2011年被發現以來,已經有超過20種MXenes被成功合成,包括Ti3C2、Ti3CN、TiNbC和Mo2C等。而在光催化領域中常被研究的MXenes主要是Ti3C2,多被用做助催化劑或者制備光催化劑的前驅體。由于Ti3C2具有良好的導電性、大量表面端基和大的比表面積,易于與其他半導體材料形成緊密的界面相互作用,從而與其他半導體材料形成Schottky結,促進光生半導體材料的光生載流子分離。另外Ti3C2由于其獨特的二維結構,因此也可以被用來作為前驅體合成半導體光催化材料。Bao等人以Ti3C2作為前驅體,在空氣氛圍中通過高溫焙燒,成功制備出TiO2/Ti3C2異質結材料。由于TiO2是在Ti3C2上原位轉變而成,因此導致了大量異質結界面存在,改善了TiO2光生載流子的遷移效率,同時由于Ti3C2表面–OH可以作為活性位點活化分子氧,提高了反應體系中活性氧物種的濃度,從而大大提高了苯甲醇氧化為苯甲醛的轉化率和選擇性。
4.4金屬有機框架化合物光催化劑
金屬有機框架化合物(MOFs)是一類由金屬團簇和有機配體通過自組裝形成的多孔晶體框架材料,是一種典型的有機無機雜化材料。研究表明,MOFs光催化劑相比于傳統的無機半導體光催化劑具有如下優點:均一和可調的孔結構、極大的比表面積、大量配位不飽和的金屬位點等。對MOFs光催化劑而言,金屬團簇可以被認為是無機半導體的量子點形式,有機配體則作為吸收光子的光敏劑,起到活化金屬團簇的作用。在MOFs的光催化體系中,從有機配體激發的光生電子只需要轉移至臨近的金屬團簇上,而不用從光催化劑的體相遷移至表相,這意味著MOFs光催化劑相比于傳統的無機半導體具有更低的光生載流子體相復合。同時,高密度的金屬團簇為催化反應提供了大量的活性位點,豐富的孔結構促進了反應物的傳質與擴散。
但是由于光生載流子復合嚴重,導致了其光催化性能較差。因此,目前主要通過引入助催化劑、構建異質結和染料敏化等措施,來對MOF材料進行改進,以提高MOF光催化劑的光吸收、光生載流子分離與傳輸效率,從而達到提高MOF光催化活性的目的。Li等人以Erythrosin B染料作為光敏劑,使得Pt-UiO-66實現了可見光輻照下光催化分解水制氫。Erythrosin B染料產生了光生電子-空穴對,并成功將光生電子轉移至UiO-66,從而實現了Pt-UiO-66的光催化活性從無到有。此外,還可以通過對MOF材料的金屬團簇或有機配體進行改性來提高MOF光催化劑的光催化活性。
4.5共價有機框架化合物光催化劑
共價有機框架化合物(COFs)是指由輕原子組成的有機分子(C、O、N、B等)通過共價鍵連接形成的具有二維拓撲結構的多孔晶體材料,是一種典型的有機材料。相比于傳統的無機半導體材料,COFs材料具有如下優點:可以通過改變基本單元來精確設計COFs的結構;COFs材料具有大比表面積且孔徑均一、高結晶度、化學和熱力學穩定性高、光穩定性好和耐酸堿性等。這些優點使得COFs作為光催化劑能夠實現光生載流子的迅速擴散,延長光生載流子的壽命和移動性,從而抑制光生載流子的復合。自Lotsch等人第一次將COFs材料應用于光催化分解水制氫以來,已經有大量的COFs材料被證實是良好的半導體光催化劑。但是COFs光催化劑的光催化活性仍然弱于常見的無機半導體材料,目前主要是通過設計不同的單體結構、與其他材料復合和構建COFs異質結等方法來改善COFs的光催化活性。Lotsch等人發現通過改變COFs材料中心節點芳環的N位點數,可以調節COFs材料的光催化活性。結果表明,中心芳環的N位點數從0提升至3,其可見光光催化產氫性能從23提升至1703μmolg-1h-1,這是由于缺電子的三嗪環相比于苯環能夠更加穩定光生自由基陰離子,從而提高了光生載流子的分離效率。Long等人構建了金屬-絕緣體-COF半導體三元復合材料,促進了光生載流子在光催化體系中的分離效率。結果顯示,金屬-絕緣體-COF半導體三元體系的光催化產氫活性是金屬-COF半導體二元體系的32倍。這是因為金屬-絕緣體-COF半導體三元體系成功實現了光生電子從COF半導體導帶至絕緣體到金屬的單向轉移,促進了光生載流子的分離,而二元體系則除了光生電子從COF半導體導帶向金屬轉移外,還存在著電子從金屬向COF半導體價帶轉移的情況,從而導致了光生載流子的復合。盡管目前COFs材料表現出巨大的應用前景,但是其依然具有如下缺點需要克服:COFs材料合成復雜;光活性的COFs結構單一,仍然需要開發出更多具有光活性的COFs;COFs的光催化機理尚不明確,需要進一步探索。
5、提高轉化效率的途徑
如前文所述太陽能到氫能的轉化效率由光吸收效率、電荷分離效率和表面催化反應效率共同決定(η轉化=η捕光*η分離*η反應),因此需要從這三個方面進行調控提升效率。
5.1吸光性能調控
拓展光催化材料的吸光范圍是提升太陽能利用的有效途徑。主要有三種策略可以縮小半導體的帶隙:(i)價帶工程,(ii)導帶工程以及(iii)導帶和價帶的連續調變。對于價帶工程,目前三種方法已被證明是有效的,包括摻雜3d過渡元素、d10或d10s2構型的陽離子以及非金屬元素摻雜,例如SrTiO3:Rh、TiO2:Cr/Sb、BiVO4、N摻雜的TiO2、TaON、Ta3N5、Sm2Ti2S2O5等;對于導帶工程,堿金屬或堿土金屬元素的替代被證明是有效的,如AgMO2(M=Al,Ga,In);對于導帶和價帶的連續調變,主要是通過形成固溶體得以實現,如GaN:ZnO、LaMgxTa1xO1+3xN23x、β-AgAl1-xGaxO2等。
5.2光生電子-空穴分離
基于光催化分解水的基本原理,促進光生載流子分離是提高太陽能轉化率的關鍵問題之一。由于光生電子和空穴需要從體相遷移到表面,首先需要提高材料體相的電荷分離效率。結晶度、粒徑尺寸、比表面積、缺陷等已被證明是影響光生載流子的分離和轉移的主要因素。例如:增加結晶度可以降低缺陷,促進電荷分離。然而,結晶度的增加往往伴隨著顆粒的燒結和比表面積的減小,因此在實際應用中需要平衡這些影響因素。除上述因素外,不同的相結構對光催化劑的性能也有明顯影響。例如,TiO2具有銳鈦礦、金紅石和板鈦礦三種相結構,雖然它們都由TiO6八面體組成,但晶體結構的不同導致了截然不同的光催化活性。形貌是另一個影響光催化性能的重要因素,多孔、納米線、納米片等形貌結構通過縮短電荷傳輸距離實現有效的電荷分離。此外,不同晶面間電荷分離現象的發現進一步推進了形貌調控在光催化系統中的重要應用。
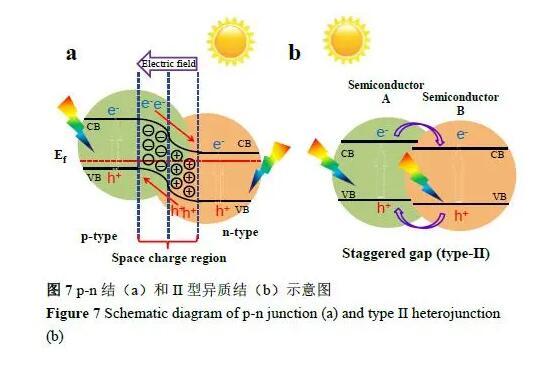
除了體相的電荷分離,抑制遷移到表面后的電荷復合同樣重要。在這方面,表界面調控是重要的策略。例如:利用ZrO2修飾TaON可減少表面的低價Ta缺陷,抑制表面電子和空穴的復合。此外,構建復合結構也是促進電荷分離的有效途徑,當兩種不同物相或將兩種物相相同而晶相不同的半導體進行復合,可構建異質結或異相結復合光催化劑。其基本工作原理是當兩種不同的介質緊密接觸時會形成“結”,在結的兩側由于其能帶等性質的不同會形成空間電勢差,這種空間電勢的存在會形成內建電場,加速電子-空穴的分離。傳統太陽能電池中通過利用p型和n型半導體之間的能級差構筑p-n結促進電荷分離,在光催化體系中也借鑒p-n結思想,通過類似的原理構筑異相結或異質結來達到分離電荷和提高光催化性能的目的(如圖7所示)。通常,半導體-半導體異質結系統可以分為兩種不同的類型:p-n型和n-n或p-p型。在過去的幾十年中,成功設計和合成了例如p型CaFe2O4和n型PbBi2Nb1.9W0.1O9、p型CaFe2O4和n型MgFe2O4異質結提高電荷分離效率。然而,由于p型半導體的數量有限且穩定性較差,構建成功的p-n結數量也相當有限,更為常見的是n-n結。例如:TiO2/CdS、BiVO4/WO3等都被證明可以提升光催化性能。該系統中,半導體之間接觸界面的設計和控制在促進電荷分離方面起著至關重要的作用。對于基于氧化物的異質結,加熱或水熱處理可以提供緊密的界面接觸。然而,對于具有優異吸光性能的(氧)氮化物來說,其空氣或惰性氣體中的熱穩定差使得異質結構筑較為困難。為了解決這個問題,我們團隊開發了一鍋氮化策略在兩個含氮半導體之間構筑異質結構,該策略不僅有效地避免了在空氣中的熱處理,而且氨氣氛圍下的高溫焙燒也有利于產生緊密的異質界面以增強界面電荷分離。此外,半導體和助催化劑之間的界面工程也極大地影響了光催化性能。通過MgO納米層(2-5nm)界面改性,Ta3N5的表面從疏水變為親水,助催化劑在親水表面的均勻分散大大改善了助催化劑與Ta3N5的界面接觸,促進光生電荷分離和水分解性能。
5.3光催化劑表面的催化轉化
光催化分解水的最后一步是遷移到表面的光生電子和空穴分別用于還原和氧化吸附物質產生H2和O2,這一步通常需要借助助催化劑來提升性能。助催化劑的主要功能是從半導體中提取光生電子和空穴,并提供氧化還原反應位點,通過降低活化能促進反應的進行。當助催化劑沉積在表面時,由助催化劑和半導體能級拉平而產生的界面處內建電場促進界面電荷轉移。助催化劑根據其功能可分為還原助催化劑和氧化助催化劑,分別用于加速釋放H2和O2的反應。
通常,Pt、Rh、Ru、Ir和Ni等貴金屬可促進H2析出,而Co、Fe、Ni、Mn、Ru和Ir的氧化物可加速O2釋放。除了助催化劑的類型,光催化性能與助催化劑的負載方法、負載量及顆粒尺寸息息相關。迄今為止,已開發原位光還原、化學還原、物理吸附、沉淀、水熱和浸漬-煅燒/還原等多種負載助催化劑的方法。小尺寸和高度分散的納米粒子有助于取得更好的催化反應活性,而過多的負載量可能會阻礙半導體的光吸收或覆蓋半導體的表面活性位點,還可能作為光生電子和空穴的復合中心,導致活性降低。
對于產氫助催化劑,貴金屬最早被開發和利用。貴金屬具有較大功函數(即較低的費米能級),有利于俘獲電子促進電荷分離。在這種情況下,通常會在金屬/半導體界面處形成肖特基勢壘。在眾多貴金屬中,Pt的功函數最大,同時其對催化質子還原的活化能最低。因此,Pt通常被認為是析氫反應的最佳候選助催化劑之一。除了貴金屬,一些過渡金屬氧化物、混合氧化物和核殼結構的納米粒子也被用作產氫助催化劑,例如NiOx、RuOx、Rh2yCryO3和貴金屬/Cr2O3等。考慮到貴金屬稀缺且價格昂貴,非貴金屬助催化劑(MoS2、Mo2N、Ni2P、WC等)被開發和利用。
產氧助催化劑主要為過渡金屬氧化物(CoOx、Co3O4、MnOx、NiOx、FeOx、IrO2、RuO2等),其中,CoOx是最常用的產氧助催化劑,它已被證明可以與多種不同的半導體相結合使用。氧化助催化劑的另一個重要作用是提高半導體的光穩定性,硫氧化物、(氧)氮化物和硫化物等半導體容易被光生空穴氧化導致自身的分解。在這些半導體表面負載氧化助催化劑可以快速提取光生空穴來釋放O2抑制N、S等的氧化。因此抑制助催化劑的化學腐蝕、光腐蝕以及調節半導體和助催化劑之間的界面性質對于提升穩定性以及促進電荷轉移非常重要。
除了無機物作為助催化劑,模擬植物光合作用開發的分子催化劑也被應用到光催化體系中,其最大的優點為催化效率高,缺點是水溶液穩定性差。但由于其尺寸小、活性位點多且結構靈活性高,成為有前途的助催化劑候選者之一,須合理設計其與半導體之間的連接,并克服水溶性差的問題。基于單一還原助催化劑和氧化助催化劑的開發,雙助催化劑的概念被提出并得到有效驗證。例如:當還原助催化劑Pt和氧化助催化劑PdS共同沉積在CdS表面,其產氫效率可達93% 420nm,為目前可見光催化半反應產氫量子效率的最高值。然而雙助催化劑并不總是表現出優于單一助催化劑的性能,主要原因目前尚不清楚,其中之一可能在于還原和氧化助催化劑的不可控的沉積而引起的相互干擾。當還原助劑和氧化助劑可以選擇性地沉積在電子或空穴富集位點時,其對光催化性能提升作用是十分顯著的。
6、光催化全分解水制氫研究進展
如前文所述,在犧牲試劑存在的情況下進行產氫和產氧半反應的測定有助于獲得特定光催化劑是否具有合適的導價帶位置信息。然而,吉布斯自由能降低的半反應是不能實現太陽能存儲的,因此組裝全分解水制氫體系是十分必要的。目前實現全分解水制氫方式有一步光激發法和兩步光激發法。在一步光激發體系中,要求半導體的導價帶應跨越H+/H2和O2/H2O的氧化還原電位,同時需要考慮諸多因素,例如光吸收、載流子遷移率、電荷分離、助催化劑和光穩定性。從熱力學的角度看,氧化物由于價帶位置更正且穩定性好是實現全分解水制氫的理想材料。目前在紫外光區,已有大約20-30種氧化物可以實現全分解水制氫,易于空間電荷分離納米級結構的La摻雜NaTaO3、Zn摻雜Ga2O3和Al摻雜rTiO3是其中的典型代表(Eg=3.2 eV)。日本的Domen課題組近期的研究利用具有不用晶面暴露的SrTiO3:Al為吸光材料,分別在其{100}和{110}晶面負載Rh/Cr2O3和CoOOH雙助催化劑后在360 nm取得95.9%的量子效率,這意味著光激發產生的電子和空穴幾乎沒有復合,接近百分百地參與了質子還原與水氧化反應,這是第一次有文獻報道全分解水制氫的效率接近自然光合作用的效率。
雖然紫外光區已報道了大量可實現分解水的材料。但可見光區目前實現全分解水制氫的材料很少,最近,一些特殊材料(Au/TiO2(表面等離子體共振效應)、CoO納米顆粒、氮摻雜氧化石墨烯量子點、MOFs、聚合物半導體)也被報道有全分解水性能,但其可重復性仍值得研究。總體而言,考慮到一步光激發對半導體的導價帶位置要求嚴格同時在同一粒子上容易發生H2和O2的復合,因此在單一光催化劑上構建全分解水仍然十分挑戰。此外由于光催化材料的吸光性能決定了太陽能到氫能的理論轉化效率,而實現太陽能-氫能的高效轉化要求半導體具有寬光譜捕光。因此基于寬光譜捕光催化劑實現一步法分解水是十分必要的,制約其效率提升的瓶頸問題主要來源于低載流子驅動力下的電荷分離,這與半導體自身的微區結構、載流子濃度、顆粒尺寸、形貌結構、助催化劑/半導體的界面結構等息息相關。
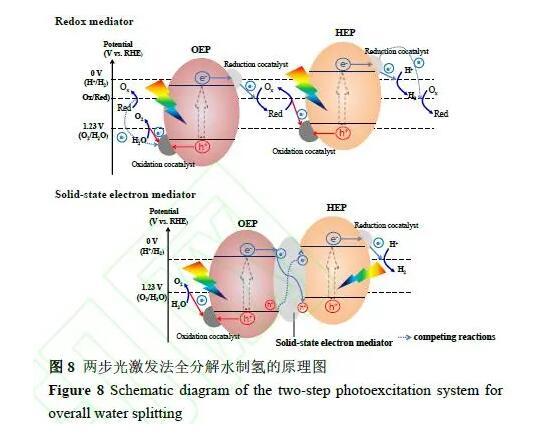
與一步光激發法不同,兩步光激發體系的構筑要求相對較低。通過模仿自然光合作用,探索出利用兩種光催化劑分別釋放H2和O2的兩步光激發體系(也稱為Z機制)。一般而言,Z機制全分解水體系由產氫光催化劑、產氧光催化劑和電子傳輸介質組成。在產氫光催化劑上,光生電子將水還原為H2;而在產氧光催化劑上,光生空穴將水氧化為O2;產氧光催化劑的光生電子和產氫光催化劑的光生空穴通過氧化-還原電對或固態電子傳輸介質完成復合。與一步法分解水體系相比,Z體系具有以下優點:(1)兩種不同的光催化劑只需分別滿足質子還原或水氧化一個條件即可,對材料的導價帶要求沒有一步法那么嚴格,更有利于寬光譜光催化材料的應用;(2)H2和O2分別在兩個半導體表面產生,有利于實現H2和O2的原位分離。然而,二步法由于需要兩次光激發的過程,生成相同量的氣體需要的光子數加倍,并且兩種半導體之間存在吸光的競爭。此外,Z體系中存在更多的競爭性電子轉移路線(如圖8虛線所示)。因此,抑制競爭反應、促進產氫光催化劑和產氧光催化劑之間的電荷轉移是實現高效全分解水的關鍵問題。
從紫外光響應的TiO2到可見光響應的(氧)氮化物(ZrO2/TaON、BaTaO2N、C3N4等)、(氧)硫化物(Sm2Ti2S2O5、(CuGa)1xZn2xS2等)、氧化物(SrTiO3:Rh)、染料敏化氧化物(香豆素染料/H4Nb6O17)均已被報道可做為產氫光催化劑。氧化物(WO3、BiVO4等)、鹵氧化物(Bi4NbO8Cl、Bi4TaO8Cl等)和(氧)氮化物(TaON、Ta3N5等)已被證明可以作為產氧光催化劑。除了半導體光催化劑外,一些天然光合酶(如PS II膜片段)也可與半導體光催化劑結合,構建Z機制全分解水體系。
在以氧化-還原電對為電子傳輸介質的Z體系中,如何控制反應的選擇性是一個重要課題。從熱力學來看,氧化-還原電對的還原電位比質子的還原電位更正,同時氧化電位比水的氧化電位更負(圖8),這使得其氧化與還原更容易進行。因此,盡管已經開發了大量可見光響應的光催化材料,但真正在可見光下表現出活性的Z機制全分解水體系數量十分有限。
電對離子的吸附、活化、解吸對克服上述問題具有重要作用。通過助催化劑擔載、表面改性、半導體與助催化劑之間的界面調節可以有效抑制競爭反應。例如,Ir、RuO2和PtOx助催化劑具有催化活化IO3-還原的能力,在Ta3N5表面修飾氧化鎂可有效抑制I離子的吸附,從而抑制其氧化。
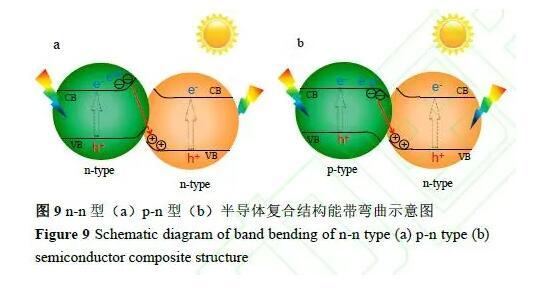
Z機制中產氫光催化劑與產氧光催化劑間的電荷傳輸還可通過固態電子傳輸介體實現。在這種情況下,主要挑戰來源于產氫光催化劑、產氧光催化劑和固體電子傳輸介質之間的界面電荷轉移,并需有效抑制短路電流的產生。目前已經探索出多種金屬(Ir、Ag、Au、Rh、Ni、Pt)、還原氧化石墨烯(RGO)和碳點作為構建全固態Z機制全分解水的固態電子傳輸介質。日本Domen課題組基于此發展了光催化劑片,該系統在419 nm下的AQY值為33%,STH超過1%,為目前文獻報道最高的STH值,其工作原理類似于光陽極與光陰極的串聯耦合,可認為是微型化的雙光照光電極器件,如在該體系中SrTiO3:Rh/La可認為是光電陰極,BiVO4:Mo可認為是光電陽極,Au可認為是導線把他們串聯連接起來。值得注意的是,只有光陰極電流和光陽極電流之間有電位的重疊,才能實現有效的電荷傳輸和雙光電極直接全分解水制氫,否則雙光照電極之間的電荷傳輸和水分解反應是無法滿足熱力學要求而實現的。同理,對于光催化粉末體系而言,構筑直接Z型光催化全分解水制氫體系同樣需要考慮其光生電子空穴傳輸的熱力學和動力學可行性,即驅動力在哪?根據光電極的工作原理和不同類型半導體(p型、n型)的能帶彎曲理論,兩種半導體之間要想實現電子和空穴的直接復合需要滿足能帶彎曲所能驅動的方向,兩種n型半導體復合在一起原理上是不能通過能帶彎曲實現直接復合的(n型半導體能帶彎曲的方向相同),而只有p型與n型的結合才能依靠能帶彎曲的不同方向實現兩種半導體之間電子和空穴的直接復合(如圖9所示)。對于二步法全分解水體系,制約其量子效率提升的瓶頸問題在于如何提升產氫端/產氧端的電荷分離以及抑制該體系中競爭反應的發生使得電荷定向應用到質子還原與水氧化反應中。這不僅與半導體自身的結構有關,也與助催化劑的選擇性催化、助催化劑/半導體的界面結構等息息相關。
 相關新聞
相關新聞