熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
材料和方法
來自葡萄園的漿果
漿果來源、葡萄樹齡、采樣時間和相應測量的詳細信息列于表1中。來自Waite Campus(34°58'04.8'''S,138°38'07.9''''E)葡萄園的漿果在2014-2015、2015-2016和2016-2017季節采樣。成熟的設拉子、霞多麗和紅寶石無核葡萄藤在標準的葡萄園管理下生長在自己的根上,垂直枝條定位,修剪枝條(兩個芽),在帶有頁巖碎片的深棕色粘土上滴灌,分級為紅棕色斑駁粘土;覆蓋在橄欖褐色斑駁的開裂粘土上(Du Toit,2005)。行(3 m間距)是南北向的。三個重復每個由兩個葡萄藤組成,每個重復的設拉子和三個葡萄藤的霞多麗。在每個重復中標記10個隨機簇(近端和遠端的組合),每個重復在09:00之間的每個采樣日期在花梗-軸交界處用鋒利的剪刀切下20個漿果(每個簇中的兩個,隨機位于簇內)小時和11點。紅寶石無核葡萄從三個葡萄藤中取樣,每個葡萄藤上有五個標記用于取樣的簇,并且從每個葡萄藤中取樣20個漿果。漿果發育過程中的采樣時間以開花后的天數來衡量(DAA,50%的花冠從花上掉下來)。漿果用密封塑料袋裝入冷卻容器中,帶回實驗室,4℃避光保存,取樣后48小時內進行檢測。
表格1 漿果來源和性狀的總結
來自盆栽葡萄樹的漿果
Shiraz和Chardonnay扦插于2015年4月從Waite葡萄園采摘,并在4°C黑暗中儲存約2周后繁殖。繁殖方法和葡萄藤營養管理基于Baby等人。(2014)。簡而言之,在4°C冷室中的加熱沙床中開始生根8周后,根長達到~6 cm后,將插條轉移到12 cm盆中的蛭石:珍珠巖(1:1)混合物中.將花盆放置在具有16小時光周期、400μmol光子m的生長室中–2 s–1)植物水平、27°C白天/22°C夜晚和50%濕度。用半強度的Hoagland溶液灌溉花盆(Baby等人,2014年)。在EL-12階段(葡萄藤Coombe,1995年)結果實的隨后被轉移到加州大學(UC)的土壤混合物中:61.5升沙子、38.5升泥炭苔蘚、50克氫氧化鈣、90克碳酸鈣和100克Nitrophoska®(12:5:1,N:P:K加微量元素;Incitec Pivot Fertilisers,南岸,維多利亞州,澳大利亞),每100升pH值為6.8,在20厘米直徑(4升)灌溉盆中之后用水。每個栽培品種的五個漿果(每個來自三個不同的葡萄樹)用于光學立體顯微鏡檢查。
霞多麗幼苗于2017年4月從Yalumba Nursery獲得,并用UC混合土壤種植在相同的生長室中,生長條件與上述相同。七株葡萄藤,每株一簇,用于O 2擴散實驗。
[氧氣 ]漿果中的輪廓
漿果[O 2]使用的克拉克型O 2尖端直徑為25μm微電極(OX-25;Unisense A/S,奧爾胡斯,丹麥)進行測量。微電極在零O中校準2溶液(0.1 M NaOH、0.1 MC 6 H 7 NaO 6)和充氣Milli-Q水(272μmol l)–1 22°C下為為100%O 2溶液。單個漿果(平衡至室溫)固定在電動顯微操作臺上。為了幫助微電極穿透漿果皮膚,在漿果赤道處用不銹鋼注射器針頭(19 G)輕輕刺穿皮膚,深度為0.2毫米。微傳感器通過這個開口被放置在漿果中,并且[O 2]分布是朝著漿果中心的深度采集的。對于設拉子,在皮下0.2毫米至1.5毫米處以0.1毫米的增量進行測量。電極沒有移動超過該點以避免損壞尖端對種子。對于不存在種子的Ruby Seedless和不存在種子或可通過半透明表皮確定種子位置的Chardonnay葡萄,從皮下0.2 mm到可以確定種子位置的間隔為0.5 mm進行測量。漿果中心。每次測量在每個深度應用10秒的持續時間。在每個位置之間,應用了20秒的等待時間以確保穩定的信號。為了測試針刺皮膚和插入微電極是否會被污染漿果內部O 2周圍的空氣,在插入部位周圍放置一個塑料環,并注入溫和流(250 ml min–1的氮氣)在獲得O同時將其施加到插入點2讀數的(圖1A)。將這些讀數與未施加氮氣的讀數進行比較。
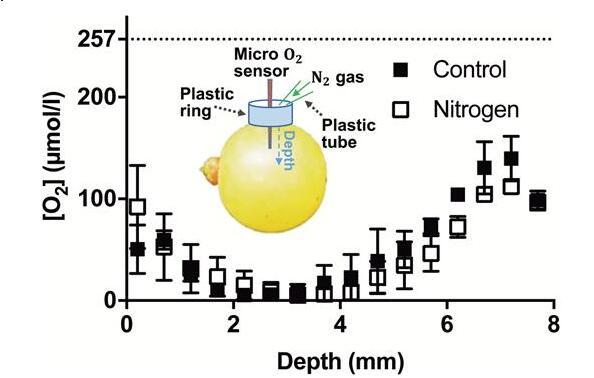
圖1
[O[O 2 2]霞多麗漿果(2016-2017年產季為90 DAA,Waite葡萄園)的]分布圖,使用和不使用N 2在測量過程中在入口點氣體進行測量。插圖:用于測量漿果[O實驗裝置2]剖面的(不按比例)。將O 2傳感器(尖端直徑25μm)插入漿果的赤道處,并大約穿過半徑向內移動到中心。在傳感器的入口周圍,一個塑料環被密封并粘在漿果上,以容納輕輕流到傳感器入口點的氮氣。數據是平均值±SE,n=3。雙向方差分析(重復測量)顯示,深度占總變異的68.73%(P<0.0001),處理占總變異的0.55%(P=0.26),交互作用占總變異的3.72%(P=0.87)。
[O 2]霞多麗漿果(2016-2017季節的90 DAA,Waite葡萄園)的[O2]分布圖,在測量過程中在入口點使用和不使用N2氣體進行測量。插圖:測量漿果[O2]剖面的實驗裝置(不按比例)。將O2傳感器(尖端直徑25μm)插入漿果的赤道,然后向內移動到大約整個半徑的中心。在傳感器的入口周圍,一個塑料環被密封并粘在漿果上,以容納輕輕流到傳感器入口點的氮氣。數據是平均值±SE,n=3。雙向方差分析(重復測量)顯示,深度占總變異的68.73%(P<0.0001),處理占總變異的0.55%(P=0.26),交互作用占總變異的3.72%(P=0.87)。
O 2使用Unisense Suite軟件(Unisense A/S)記錄讀數。每個生物重復測量三個漿果。每個步驟的平均值和SE(n計算=3)并[O 2使用GraphPad Prism 7(GraphPad Software Inc.,La Jolla,CA,USA)編譯]分布。在O 2測量之后,使用帶有K型熱電偶珠探針(Fluke 80PK-1)的IR溫度計(Fluke 568,Fluke Australia Pty Ltd,NSW,Australia)記錄漿果溫度。赤道的漿果直徑是用數字卡尺測量的。[O 2]和呼吸(見下文)在昏暗的房間照明下測量,<1μmol光子m–2 s–1。測定漿果活力(見下文),并使用數字折光儀(日本東京愛宕)作為漿果成熟度的指標測定單個漿果汁液的總可溶性固形物(TSS)。
測試花梗皮孔的作用
[O 2]如上所述測量,但探針沿漿果中心軸固定在距花梗約2毫米處。獲得穩定讀數后,N 2氣(250 ml min–1然后將)施加到花梗上,以測試花梗皮孔對O的貢獻2擴散到漿果中。
漿果和種子呼吸O 2消耗
Clark型氧微傳感器OX-MR和MicroRespiration System(Unisense A/S)用于漿果和種子呼吸測量。一個復制品由九個漿果組成。測量室充滿充氣的MilliQ水,不斷攪拌,并在水浴中保持在25°C。在測量整個漿果的呼吸后,提取九個漿果的種子并使用相同的設備測量種子呼吸速率。室內水[O 2監測]的變化至少15分鐘,每5秒讀取一次讀數,以便根據[O下降的斜率確定穩定的呼吸率2]。
還測量了設拉子和霞多麗漿果在用硅脂(SGM494硅脂,ACC Silicones Limited,Bridgewater,UK)覆蓋花梗之前和之后的呼吸作用,已知該硅脂會限制漿果花梗吸水(Becker等人,2012年),在20°C和40°C。另一批九個霞多麗漿果用于確定切除花梗的呼吸作用。
漿果呼吸的溫度依賴性是通過保持在10、20、30和40°C的水浴來確定的。
花梗皮孔密度
使用帶CCD相機的Nikon SMZ 25立體顯微鏡(Nikon Instruments Inc.,Melville,NY,USA)評估霞多麗和設拉子漿果花梗(莖和容器)的皮孔密度。使用ImageJ(估計豆瓣面積(%)Schneider等人,2012年)通過首先調整圖像的顏色閾值以將花梗與背景分開,然后將皮孔與花梗分開來。隨后,使用感興趣區域(ROI)管理工具來估計花梗和皮孔的相對面積。
阻斷花梗皮孔的遠期效果
在成熟開始時(漿果軟化的最初跡象),每串生長箱式霞多麗上大約一半漿果的花梗都覆蓋有硅脂。在施用后第3、5、7、10、12、14和18天,在整個實驗過程中隨機取樣兩或三對漿果,每對含有來自一株植物的一個覆蓋和一個未覆蓋(對照)花梗.漿果[O 2]的分布如上測量,隨后評估漿果的細胞活力(見下文)。在有機硅應用后12天和20天對三對漿果進行取樣,并評估內部乙醇濃度(見下文)。
漿果乙醇濃度
在液氮下將單個漿果研磨成細粉。按照制造商的說明(Megazyme International Ireland Ltd,Wicklow,Ireland)使用乙醇測定試劑盒對乙醇進行定量。簡而言之,乙醇脫氫酶(ADH)催化乙醇氧化為乙醛。然后在醛脫氫酶(AL-DH)和NAD的存在下將乙醛進一步氧化成乙酸和NADH+。在FLUOstar Omega讀板器(BMG LABTECH GmbH,Ortenbery,Germany)中在340 nm處測量NADH的形成。
果皮細胞活力評估
如詳細介紹的,使用熒光素二乙酸酯(FDA)染色程序對漿果的切割內側縱向表面進行了Tilbrook和Tyerman(2008年)評估以及Fuentes等人。(2010)。使用MATLAB(Mathworks Inc.,Natick,MA,USA)代碼分析圖像以確定漿果細胞活力(Fuentes et al.,2010)。使用ImageJ,分析了赤道半徑上的FDA熒光信號。檢查了[O之間的相關性2]與霞多麗和紅寶石無核漿果內相應距離處熒光信號。也以這種方式分析了有或沒有花梗覆蓋的生長室生長的霞多麗漿果的熒光信號。
漿果內的空氣空間
在2015-2016季節期間對霞多麗漿果進行了micro-CT采樣,其中每個采樣時間使用三個漿果,每個漿果來自不同的重復。在Adelaide Microscopy的微型CT設備中使用Skyscan 1076(Bruker micro-CT,比利時Kontich)對葡萄進行成像,其中整個漿果(附有花梗)具有59 kV、149μA、Al 0.5 mm的二維投影過濾器、2356 ms曝光、0.4°旋轉步長和8.5μm像素大小(相當于15μm空間分辨率或3×10–6 mm 3體素大小)。NRecon(bruker-microct.com)用于灰度圖像重建。使用CT-Analyer(bruker-microct.com),將Otsu閾值應用于體積,并應用去斑以僅接受超過500個體素的連續體積作為連接的空氣空間。使用CTVox(bruker-microct.com)生成內部空氣空間的三維圖像;顯色模塊用于區分內部空氣體積和漿果體積。然后將3-D模型縱向剖切以顯示內部空氣空間分布。通過手動選擇感興趣的體積并接受500個體素作為空氣空間,對漿果近端區域和種子頂部(種臍)之間的內部孔隙度進行定量分析。
統計分析
所有數據均表示為平均值±SE。雙向方差分析用于:O 2傳感器深度和施加N 2在傳感器入口處氣體對[O 2]的影響、O 2傳感器深度和成熟階段對[O 2]的影響、溫度和覆蓋皮孔對呼吸的影響、溫度和葡萄成熟度對呼吸Q 10的影響、覆蓋皮孔的影響和覆蓋持續時間對[O 2]、TSS、每個漿果的糖分、乙醇和活組織特征。Deming回歸用于確定FDA染色的熒光強度與[O之間的關聯2];這種類型的回歸考慮了的誤差x和y(Strike,1991)。t檢驗用于以下方面的差異:兩個成熟階段霞多麗的漿果和種子的呼吸作用、霞多麗和設拉子之間花梗上的皮孔面積O活化能2的、霞多麗和設拉子漿果吸收,以及霞多麗的孔隙度和連通性指數兩個成熟階段。使用線性回歸確定皮孔覆蓋的漿果和對照漿果中CD的比率。
 相關新聞
相關新聞