熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
沉積物和地下水收集
沉積物樣本于 2012 年 12 月和 2013 年 7 月從日本廣島大學 (34°24.060 N, 132°42.790 E) 的 Budo Pond 收集。 采樣點的特點是在地下水排放點附近有大量的橙色沉積物(圖 1A)。 地下水緩慢流過沉積物表面,從管道流向開放的池塘。 外框和池底用混凝土覆蓋,從而確保管道是池中地下水的唯一來源。 沉積物分布在距地下水源約 1.5 m 處。 沉積物的深度為 15-120 厘米,具體取決于其與管道的距離。

圖 1 日本廣島大學武道池(A)沉積物照片。 地下水從管道供應到開放的池塘。 大量的 Fe(III) 沉積物散布在管道附近。 箭頭表示地下水的流動方向。 從圖 A 所示的管道(地下水源)30 厘米處收集的 (B) 沉積物芯的照片。在一系列沉積物中,顏色明顯變化。
通過將丙烯酸管(直徑,8 厘米;長度,15 厘米)直接插入沉積物中來收集兩個核心。 在距地下水源 30 厘米處收集兩個沉積物核心。 一個核心用于 16S rRNA 基因分析、礦物物種形成和孔隙水化學表征,而另一個用于微電極和 大麻分析。
從管道供應的地下水(圖 1A)與巖心取樣的同一天收集。 使用 0.2 lm 膜(Advantec,東京,日本)過濾地下水,并如下所述進行化學分析。
pH、氧化還原電位和溶解氧的微電極分析
沉積物中的溶解氧 (DO)、pH 值和氧化還原電位 (Eh) 在實驗室中使用微電極并按照 Shiraishi 等人描述的方案進行測量。 (2010)。 DO 和 Eh 電極購自 Unisense (Aarhus, Denmark)。 pH 電極按照 Gieseke & de Beer (2004) 的描述制備。 用于微電極分析的沉積物核心在我們的實驗室中在室溫下儲存約 1 小時,以允許在樣品運輸過程中可能被攪動的顆粒沉降。 使用電動顯微操作器 (Unisense) 以 1 mm 的間隔進行從 0 cm(水-沉積物界面)到 4 cm 深度的微電極測量。 在沉積物深度低于 4 cm 時,通過將微電極直接水平插入巖心采樣器塑料體上的小孔中,以 2 cm 的間隔進行微電極測量。 DO微電極的檢測限為0.3 lM。
孔隙水取樣和化學分析
在缺氧室(Coy Laboratory Products, Grass Lake, MI, USA; Ar:H2 = 98%:2%; [O2] < 0.01 ppm)。 然后通過使用 0.2-lm 膜過濾器 (Advantec) 的真空過濾將所得樣品分離為孔隙水和沉積物相。 收集孔隙水后,根據 Fadrus & Maly (1975) 描述的方案,通過 1,10-菲咯啉方法通過分光光度法測量溶解的 Fe2+ 濃度。 在缺氧室中,從沉積物中分離出的孔隙水立即與醋酸銨緩沖液中的 1,10-菲咯啉混合。 使用分光光度計(Thermo Scientific GENESYS 20;Thermo Fisher Scientific Inc.,Osaka,Japan)在 510 nm 波長處測量紅色溶液。
剩余的孔隙水用于測定無機和有機離子濃度。 使用離子色譜儀(Dionex ICS-1100;Thermo Fisher Scientific Inc.)鑒定主要陽離子(Na+、K+、Mg2+、Ca2+)和離子(Cl–、硫酸根和NO?3)。 使用電感耦合等離子體原子發射光譜儀(ICP-AES SPS3510;SII Nano Technology Inc.,Tokyo,Japan)測定溶解的 Mn2+ 濃度。 堿度通過 Gran 滴定法用 0.1 M HCl 測定。 通過 Ijiri 等人描述的方法測量乙酸鹽濃度。 (2012) 使用同位素比監測液相色譜質譜儀,其中包括連接到 Thermo Scientific LC IsoLink 的 Thermo Finnigan DELTAplusXP 同位素比質譜儀 (IR-MS)。
鎂濃度和穩定同位素分析
沉積物中孔隙水濃度在 0-10 cm 范圍內的所有深度進行測量。 此外,在7 cm以下的深度測量孔隙水的碳和氫穩定同位素,以闡明沉積物中形成甲烷的途徑。 將大約 6 g 切片的濕沉積物插入 20 mL 血清瓶中,并向瓶中加入 1 mL 飽和氯化汞以阻止任何微生物活動。 然后用丁基塞子卷曲密封瓶子。 在分析之前,將樣品置于熱水浴(約 80°C)中 15 分鐘,以對沉積物中溶解的蒸發進行脫氣。 對于地下水測量,大約 10 mL 未過濾的地下水被收集到 10 mL 丁基塞血清瓶中。 在用丁基塞進行卷邊密封之前,將 1 mL 等分的飽和氯化汞加入瓶中。 用同位素比監測氣相色譜質譜儀測定了鎂的濃度和穩定同位素組成。 穩定同位素組成由下式計算:
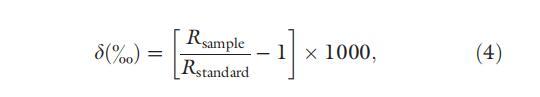
其中 Rsample 和 Rstandard 分別表示樣品和內標中的 13C/12C 或 D/H 比率。 分別使用 Vienna Pee Dee belemnite 碳酸鹽和 Vienna Standard Mean Ocean Water 作為碳和氫的內標。 本研究中使用的 IRG 配備了一個端口,該端口在氧化為 340 °C 的 340 °C 下選擇性捕集蒸發 CMS 以進行 d13C 測量。 對于 d 測量,在 1450 °C 下進行熱解,并將產生的樣品氣體(或 H2)引入 IR-MS。
HCl 可萃取的 Fe 分析
使用兩種濃度的 HCl(0.5 和 6 M)并行進行酸提取,以量化沉積物中的 Fe 含量。 在缺氧室中對沉積物取樣后,將切片的沉積物用無 O2 的 MilliQ 水(Millipore,Tokyo,Japan)洗滌兩次,以去除沉積物中溶解的 Fe2+。 為避免實驗過程中 Fe(III) 還原或 Fe(II) 氧化,根據 DO 曲線改變了實驗條件。 來自 0-2 厘米深度范圍內的沉積物樣品,其中存在好氧到缺氧條件,在室溫下進行有氧處理。 2 厘米以下的沉積物樣品,其中存在缺氧條件,在室溫下在缺氧室中進行厭氧處理。 樣品干燥后,用 5 mL 0.5 M 或 6 M HCl 處理每個深度的兩份 10 mg 沉積物 1 小時。 通過ICP-AES分析溶解的Fe。 溶解在 6 M HCl 中的 Fe 礦物對應于總 Fe 含量 (Poulton & Canfield, 2005)。
大塊和表面敏感的 Fe K 邊緣 EXAFS 分析 大塊 Fe K 邊緣 EXAFS 光譜是在 SPring-8(日本兵庫)使用光束線 BL01B1 獲得的。 測量是使用完全調諧的 Si (111) 雙晶單色儀進行的,帶有鍍鎳反射鏡,角度為 6.0 mrad。 光束尺寸調整為大約 1 9 0.8 mm2。 通過將赤鐵礦的前邊緣峰值最大值設置為 7111 eV 來校準能量。 所有樣品,包括標準礦物(水鐵礦、針鐵礦和菱鐵礦)和沉積物樣品,均在快速 EXAFS (Q-EXAFS) 透射模式下進行分析,其中 EXAFS 光譜從 6790 到 7680 eV。 濕沉積物樣品安裝在混合纖維素酯膜(Millipore,Billerica,MA,USA)上,然后密封在缺氧室中。 樣品保存于 ? 分析前 80 °C。 Q-EXAFS 光譜分析三次。 我們的結果證實在測量過程中沒有發生光子氧化或還原。
在 CEY 模式下,通過 Fe K-edge EXAFS 分析表面敏感的 Fe 礦物種類。 使用光子工廠(日本筑波)的光束線 BL12C,使用帶有 Rh 涂層反射鏡的全調諧 Si(111)雙晶單色器以 7.0 mrad 的角度進行測量。 Itai 等人描述了本研究中使用的 CEY-EXAFS 技術和設備的詳細信息。 (2008)。 CEY-EXAFS 測量是使用 CEY 檢測器單元進行的。 石墨電極放置在 CEY 檢測器單元的中心,并用金屬盒覆蓋以保持 He 氣氛。 將與用于 HCl 可萃取 Fe 分析的相同的干燥樣品分散在一塊碳帶上。 然后將該膠帶貼在一塊鋁箔上,然后將其放置在石墨電極上。 在測量過程中,高壓電源固定在 300 或 400 V。 合成水鐵礦的 CEY-EXAFS 光譜被證實與在體透射模式下測量的樣品相同。 使用 ATHENA EXAFS 分析軟件包 (Ravel & Newville, 2005) 分析所有 EXAFS 數據。
TEM 觀察沉積物的微觀結構和礦物學通過 TEM (JEOL JEM-2010, Tokyo, Japan) 進行研究。 無論沉積層的深度如何,樣品制備都是在缺氧室中進行的。 將選定層的少量沉淀物轉移到無菌的 1 mL 微量離心管中。 將乙醇以一系列分級濃度(30%、50%、70%、80%、90% 和 100%)加入管中。 使用移液管輕輕混合溶液。 每個乙醇濃度脫水10分鐘,離心后傾析上清液(2000 9g;2分鐘)。 加入100%乙醇后,將一滴懸浮樣品置于銅網上。 網格在缺氧室中干燥過夜。 樣品在從缺氧室中取出之前進行密封,以防止樣品運輸過程中 Fe(II) 礦物的氧化。 TEM觀察在200kV的加速電壓下進行。
使用 16S rRNA 基因克隆文庫進行分析
使用乙醇消毒的刮刀將沉積物樣品切片后,將它們轉移到缺氧室中的消毒離心管中并儲存在 ? 分析前 80 °C。 對代表性層,即 1 和 2 厘米(表層)、4 和 10 厘米深度處的沉積物混合物進行 16S rRNA 基因分析,以確定微生物群落隨著沉積物層深度的增加而發生的變化。 根據制造商的說明,使用 DNA 分離試劑盒(PowerMax 土壤 DNA 分離試劑盒;MoBio Laboratories, Carlsbad, CA, USA)提取 DNA。 使用 530F 和 907R 引物組的通用引物擴增 16S rRNA 基因,從而靶向細菌和古細菌 16S rRNA 基因(Nunoura 等,2012)。 16S rRNA 基因片段通過聚合鏈反應 (PCR) 擴增(Nunoura 等,2012)。 PCR產物通過凝膠電泳驗證并使用MiniElute凝膠提取試劑盒(Qiagen,Tokyo,Japan)純化。 然后將 PCR 產物轉化到感受態大腸桿菌菌株 K12 中。 克隆在 37°C 下孵育過夜,隨機選擇總共 94 個克隆并測序(3730XL DNA 測序儀;Applied Biosystems, Carlsbad, CA, USA)。
具有 > 97% 同一性的 16S rRNA 基因序列被分組到一個可操作的分類單元中。 使用基于 ARB-SILVA 106 數據庫 (www.arb-silva.de) 的 ARB 軟件包 (Ludwig et al., 2004) 進行系統發育分析。 細菌和古細菌的系統發育樹是使用 MEGA5 的最大似然法構建的(Tamura 等,2011)。
 相關新聞
相關新聞