熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
微囊藻菌落可在沉積物中越冬,并可通過補充接種水柱,促進微囊藻水華的年度復發。通過微觀實驗,通過闡明底棲微囊藻在不同沉積條件下的細胞數量、光合活性和毒素含量動態,定量研究了底棲微囊藻的存活能力。在5°C下22周的實驗中,沉積物樣品中微囊藻菌落的豐度沒有顯著降低,而超過90%的底棲生物種群在25°C條件下3個月內死亡。微囊藻菌落在表層沉積物需氧條件下的存活率顯著低于深層沉積物厭氧條件下的存活率。毒性銅綠假單胞菌和無毒魏森伯格假單胞菌表現出相似的生存能力,雖然銅綠假單胞菌在15和25°C下的最終存活效率高于威森伯格假單胞菌。微囊藻毒素配額在5和15°C下保持穩定,但在25°C下顯著降低。底棲微囊藻群體的光合活性逐漸降低,在較高溫度下下降幅度較大。我們的研究表明,大多數底棲微囊藻群體能夠成功越冬,微囊藻毒素得以保存,光合活性得以維持,顯著增加了水華形成的風險。然而,多年來,它們無法在亞熱帶淺水湖泊的沉積物中積累。
微囊藻是富營養化淡水中常見的主要成花生物,可產生一系列被稱為微囊藻毒素(MCs)的強效肝毒素。在富營養化湖泊中,大量藍藻微囊藻可能在仲夏和秋季沉入沉積物中,然后在湖底存活(Tsujimura等人,2000年)。沉積物中微囊藻菌落的累積生物量可被視為一個種子庫,并可在重新注入水柱后作為中上層水華的接種物,有助于淡水生態系統中這種藍藻的生態成功和水華形成(Brunberg and Blomqvist 2002;Sabart et al.2014)。Verspagen等人(2005年)模擬了伏爾克拉克湖(荷蘭)底棲微囊藻和中上層微囊藻種群之間的關系,發現沒有底棲微囊藻的補充,使藻華減少了50%。通過分析太湖(中國)水華的時空模式,發現水華可能首先發生在前一年深秋藍藻積累的地區(Tan等人,2010年)。在美國伊利湖,調查和分析表明,沉積物最有可能是微囊藻水華的來源(Chaffin等人2014;Sabart等人2014)。鑒于底棲微囊藻的重要性,需要對微囊藻群體的底棲行為進行研究,以更好地了解微囊藻水華形成的機制(Latour等人,2004年;Verspagen等人,2005年)。
目前對微囊藻群落底棲行為的研究主要依靠實地調查。在不同水體的沉積物中觀察到大量存活的微囊藻菌落,盡管豐度存在顯著差異(Cires等人2013年;Latour等人2004年;Misson等人2012b),從100到200000毫升不等?1(Verspagen等人,2004年),底棲微囊藻的動態可能呈現不同的趨勢(Ihle等人,2005年;Tsujimura等人,2000年)。在Quitzdorf水庫(德國),底棲微囊藻的生物量在春季末急劇下降,在夏季和冬季保持穩定(Ihle等人,2005年)。在琵琶湖(日本)的淺部,從冬季到初夏,底棲微囊藻的生物量減少,而在瓦倫圖納斯金湖(瑞典)(布倫伯格,1999年)或琵琶湖的深部(70-90米)(Tsujimura等人,2000年)沒有記錄到生物量下降。在某些沉積物條件下,微囊藻菌落可以存活長達7年(Bostr?m等人,1989年;Latour等人,2007年;Misson等人,2012b)。據我們所知,底棲微囊藻的生存能力尚未得到定量研究。因此,我們旨在確定影響底棲微囊藻菌落存活能力的主要因素,以及這些菌落在各種沉積物條件下的存活時間。
實地調查不足以清楚地揭示微囊藻菌落在沉積物條件下的生存能力,因為底棲微囊藻豐度的減少可能歸因于細胞溶解或底棲菌落的補充。為了明確確定沉積物中微囊藻菌落的存活能力,必須抑制浮游和底棲種群之間菌落的交換。因此,需要通過模擬實驗進行系統和定量研究,以評估微囊藻菌落在不同沉積條件下的存活能力。此外,只有當它們具有足夠的生理活性以恢復生長時,底棲微囊藻群才有可能接種水柱并促進該屬的夏季開花特征。使用PhytoPAM檢測沉積物中分離的微囊藻菌落的光合作用活性是評估底棲微囊藻菌落恢復生長潛力的有效方法。
有毒和無毒微囊藻菌落總是共存于水體中。有毒和無毒細胞的相對比例以及細胞內的含量水平決定了底棲微囊藻種群的毒性,它們是下一季微囊藻水華的孕育劑。微囊藻物種可以在整個底棲階段保存MCs;保存在有毒細胞中的MC可能有利于越冬,在沉積物中以及MC含量高或低的有毒細胞之間的生存能力方面,有毒微囊藻物種可能比無毒微囊藻物種具有競爭優勢(Ihle et al.2005;Mohamed et al.2006;Latour et al.2007;Misson et al.2012b)。Schatz等人(2007年)證明,微囊藻細胞裂解刺激剩余細胞產生更多MC,從而增強其生存能力。此外,拉圖爾等人(2007年)發現,長期掩埋的底棲微囊藻種群的MC含量顯著高于新定居種群的MC含量(拉圖爾等人,2007年)。因此,確定有毒和無毒微囊藻菌落之間的競爭差異,以及在沉積物條件下有毒細胞中MC含量的動態變化非常重要。
我們在實驗室構建了微宇宙,以定量研究微囊藻菌落在各種底棲條件下的生存能力,主要目的是(i)闡明微囊藻菌落在各種沉積物條件下的生存能力,(ii)確定有毒和無毒微囊藻菌落之間是否存在影響底棲生物存活的種間差異,以及(iii)揭示底棲微囊藻的光合活性和細胞內MCs的動態。這項研究的結果將進一步加深我們對底棲微囊藻種群行為和富營養化湖泊中微囊藻水華形成機制的理解。
藻類培養和培養條件
本研究中使用的兩種菌落形成微囊藻菌株的純培養物銅綠微囊藻CHAB 5059和威森伯格微囊藻CHAB 1211由李仁輝教授(中國科學院水生物研究所,武漢,中國)提供。有毒的銅綠假單胞菌菌落含有大量的MC-LR和MC-RR。在衛森伯格支原體細胞中未檢測到MCs。如前所述(Tan等人,2010年)分離菌株,并在25°C條件下,在MA培養基中以12小時光照/12小時暗循環培養(Kasai等人,2004年)。在實驗之前,對培養物進行放大,直到每個菌落形成微囊藻菌株獲得足夠的生物量。在整個培養過程中,每個菌株的菌落特征保持不變。
沉積物和水
沉積物和水來自東湖(北緯30°33.0367N,東經114°22.4832E)。沉積物通過60μm的篩子過濾,以防含有可能損壞微電極的大顆粒(OXY25,Unisense,丹麥)。一小部分沉積物經過冷凍干燥、粉碎,并通過60μm的篩子。湖水通過0.45μm的醋酸纖維素膜過濾以去除藻類。
實驗環境
本實驗使用塑料注射器(50ml);注射器筒的頂部被切斷,底部用橡膠柱塞密封(圖1)。沉淀物、藻類和過濾水被一層一層地添加到桶中。首先,添加15毫升沉積物作為初始層。添加沉淀物和菌落微囊藻(3 mL)的混合物作為第二層。第三層和第四層分別與第一層和第二層相同。接下來,將0.5g凍干沉淀物均勻地灑在第四層上。最后,緩慢添加10毫升過濾后的湖水作為第五層,以模擬沉積物和微囊藻的再懸浮。注射器筒的外部覆蓋著錫箔,頂部覆蓋著透氣膜。為了比較有毒銅綠假單胞菌和無毒威森伯格假單胞菌的存活能力,將這些裝置分為三組,并添加了各種藻類。第一組中添加銅綠微囊藻,第二組中添加魏森伯格微囊藻。在第三組中,將等量的綠膿桿菌和威森貝格氏桿菌混合并添加到桶中(稱為微囊藻屬)。三組微囊藻菌落的細胞密度均為2.3×108±1.2×107。將微宇宙(圖1)置于培養箱中,并在三種不同溫度(5、15和25°C)下保持在黑暗中。
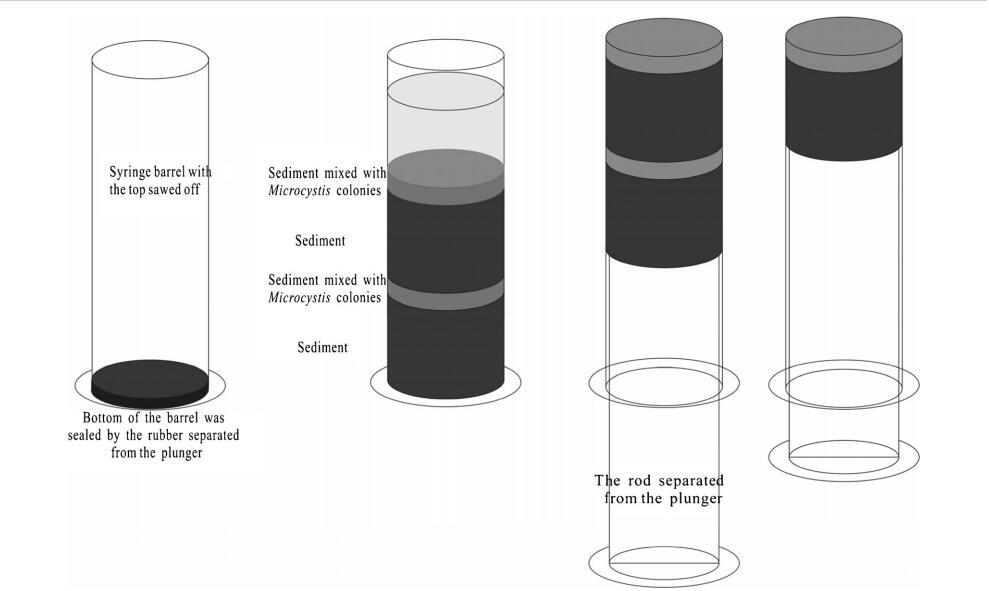
圖1模擬微囊藻群落的底棲環境
使用微電極(OXY25,Unisense,丹麥)測量水-沉積物界面的氧氣分布,如之前的研究(Tian等人,2015)所述。
取樣
我們的前期實驗表明,微囊藻菌落的壽命隨溫度變化很大。因此,針對不同的溫度設置了不同的采樣間隔。實驗持續了22周,每1周、2周或4周采集一次樣本。每次取樣時,從每組中隨機抽取兩桶進行取樣。
去除覆蓋水后,用柱塞桿緩慢排出沉積物芯(圖1)。將兩層混合沉淀物和微囊藻菌落(即第二層和第四層)切掉并轉移到50 mL離心管中,并向每根管中添加15 mL 40%Percoll(瑞典阿默森生物科學公司)溶液。充分混合后,將混合物以4000×g離心10分鐘。將含有微囊藻菌落的上清液通過孔徑為10μm的篩網過濾,以收集所有藍藻菌落。然后輕輕沖洗篩子上的微囊藻菌落,并將其懸浮在10毫升MA培養基中,以供日后分析。
微囊藻細胞密度的測定
為了計數底棲微囊藻,將含有微囊藻菌落的10mL MA培養基的等份(各1mL)用0.01mol L水解?如前所述(Wang等人,2015),在85°C溫度下使用NaOH進行8分鐘,并使用流動攝像機和顯微鏡(FlowCAM)進行自動研究。
存活率在沉積物中存活一段時間的微囊藻細胞百分比被用來代表微囊藻菌落在不同環境條件下的存活率。
微囊藻的光化學效率分析
PSII的最大光化學效率(Fv/Fm)是使用脈沖調幅熒光監測系統(德國沃爾茲Phyto PAM)測量的。暗適應5分鐘后,在弱光條件下(0.15μmol/m)測量原始熒光(Fo)和最大熒光(Fm)?2秒?1)以及3516μmol/m的飽和光脈沖?2秒?分別為1,持續0.8秒。PSII的最大光化學效率(Fv/Fm)計算為Fv/Fm=(Fm)?Fo)/Fm(Wang等人,2014年)。
微囊藻毒素的提取與測定
在4°C條件下,使用3毫升100%甲醇(最終濃度為75%)在含有微囊藻菌落的10毫升MA培養基中提取等份(各1毫升)的MC 24小時。離心后,使用由Waters 2695分離模塊、Waters 2996光電二極管陣列檢測器和Waters Empower色譜軟件(Waters,USA)組成的系統,通過高效液相色譜法(HPLC)測定上清液中的MC含量(Wu等人,2009)。通過比較238nm處的峰面積與MC標準品(美國西格瑪·奧爾德里奇)的峰面積來確定MCs的濃度,并在Synergi Hydro RP C18柱(4μm,250mm×4.6mm)上分離MCs。
統計分析
通過重復方差分析(ANOVA)考察了溫度、微囊藻種類和沉積層對存活率、光化學效率和微囊藻毒素含量的影響。數據以平均值±標準偏差(SD)表示。Mauchly檢驗用于通過重復方差分析評估球形度,溫室-蓋瑟球形度估計用于糾正違反Mauchly檢驗的數據中的自由度。在三因素重復方差分析中發現顯著交互作用的情況下,對每個溫度進行單因素方差分析。在進行單因素方差分析后,進行事后Tukey檢驗以確定顯著分組。所有統計分析均使用IBM SPSS Statistics 19軟件(美國IBM公司)進行。使用Origin 8.0軟件(美國OriginLab)生成圖形。