熱線:021-66110819,13564362870
Email:info@vizai.cn


熱線:021-66110819,13564362870
Email:info@vizai.cn
緊密耦合的微生物群落在時空尺度上調節生物地球化學循環,這通常無法通過傳統分析方法進行檢測。粉紅色漿果提供了一個可訪問的模型系統來研究與聚集體相關的“神秘”硫循環,這一過程可能在全球生物地球化學轉化中發揮重要作用。例如,在海洋系統中,據報道,在來自最低氧區的未檢測到硫化物的區域中存在豐富的硫化物氧化譜系(SUP05、SAR324、Agg47)(Walsh等人,2009年;Canfield等人,2010年;Fuchsman等人)al.,2011)到含氧深海(Swan et al.,2011)。有關這些硫化物氧化譜系與下沉有機顆粒(海洋雪)相關的報告表明,它們與硫酸鹽還原物種存在同養伙伴關系,盡管尚未證明這種還原硫化合物的種間轉移。最近的工作還表明,來自酸性礦山排水的聚生體(Norlund都發生了種間硫轉移等人,2009年)和負責深海甲烷厭氧氧化的同養聚生體(Milucka等人,2012年)。
粉紅色漿果,主要由紫色硫細菌物種(PB-PSB1,Chromatiaceae)和推定的硫酸鹽還原細菌物種(PB-SRB1,聚生體Desulfobulbaceae)組成的,提供了一個易于處理的系統來開始解密驅動硫循環的微生物代謝伙伴關系在微觀層面。基于系統發育信息(即這些物種養殖近緣種的生理學)和粉紅色漿果的保守空間結構的組合,我們假設PB-SRB1對漿果內硫酸鹽的還原為PB-PSB1提供了硫化物的局部來源(圖.9).即使在外源硫化物含量低或不存在的情況下,這種關聯也會使PB-PSB1保持光合活性,例如在峰值光照條件下,當沉積物中的趨化層相對于其夜間水平向下移動幾厘米時(Revsbech等人,1983年);狄龍等人,2009年)。驅動硫酸鹽還原的電子供體可以由光合產物局部提供,也可以由沉積物外源提供(圖9)。宏基因組測序證實了這種漿果內硫循環的遺傳潛力;硫酸鹽還原和硫化物氧化的完整代謝途徑分別存在于PB-SRB1和PB-PSB1的基因組中。
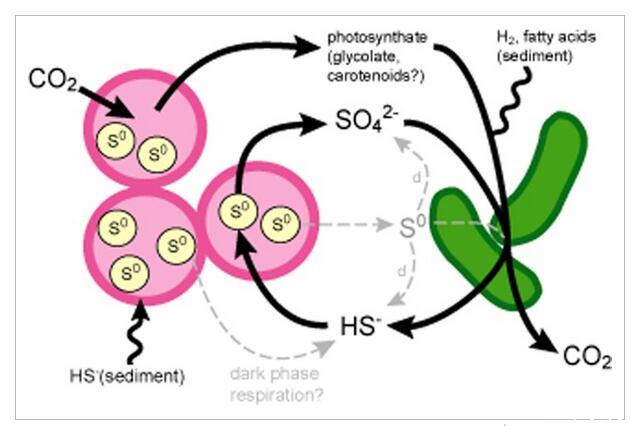
圖9
粉紅色漿果財團中硫循環的模型。PB-SRB1(綠色棒)將硫酸鹽還原為硫化物,氧化來自外源沉積物來源或由PB-PSB1產生的本地提供的光合產物的各種電子供體。PB-PSB1(粉紅色球菌)消耗自養硫化物,將硫化物氧化成硫酸鹽,并在細胞內儲存元素硫(S 0,淡黃色圓圈)。如果PB-PSB1細胞裂解,PB-SRB1(灰色虛線箭頭)可能會減少和/或使細胞內硫不成比例。PB-PSB1(HS一些電子供體-)和PB-SRB1(H 2或脂肪酸)的也可能由沉積物流出的化合物(波浪線)外源提供。白天,光養型PB-PSB1將CO固定2到生物質中,而在夜間,它可以通過呼吸元素硫和細胞內碳水化合物儲備并產生硫化物來獲取維持能量。盡管PB-SRB1基因組表明具有固定CO的遺傳潛力2,但我們的穩定和放射性碳實驗的結果表明,在我們的孵化條件下,PB-SRB1對漿果中的碳固定沒有顯著貢獻。
為了測試這種代謝模型,使用高分辨率地球化學方法(SIMS、nanoSIMS、微伏安法)來跟蹤從硫代謝物庫到細胞特異性硫同化和生物分子的神秘硫循環。Sulfur-34穩定同位素標記使我們能夠跟蹤聚集體中硫的流動,從PB-SRB1對硫酸鹽的還原,到種間轉移和摻入PB-PSB1細胞。在與孵育后34富含S的硫酸鹽,我們在PB-PSB1細胞中觀察到點狀、溶劑不穩定的硫34富集(圖8),這與細胞內硫球中標記硫的積累一致(圖3)。
PB-PSB1的這種硫34富集不太可能通過直接摻入同位素標記的硫酸鹽而發生。的細胞硫Chromatiaceae物種主要由元素硫的周質儲存(細胞總重量的34%)支配,它完全來自還原硫池(Dahl和Prange,2006年)。此外,許多染色科,包括與PB-PSB1最接近的培養近緣種,無法同化硫酸鹽(Dahl,2008;Kumar et al.,2009)。即使在那些可以同化硫酸鹽的物種中,這一過程也被認為在缺氧光石營養生長過程中受到抑制(Neumann等人,2000年;Sander和Dahl,2008年)。在光有機營養生長過程中,模型Chromatiaceae物種Allochromatium vinosum通過cysTWA硫酸鹽ABC轉運蛋白和硫酸鹽cysDN解酶同化ATP-硫同化。這些基因的同源物在PB-PSB1基因組中未發現,以及對整個組裝宏基因組數據恢復搜索從基因更密切相關的那些從生物體只有遙遠的序列匹配擬桿菌,α-變形菌或Desulfobulbaceae。
由于直接34 PB-PSB1細胞不太可能摻入S-硫酸鹽,我們建議PB-SRB1將34 S-硫酸鹽標記還原為硫化物,然后被PB-PSB1吸收并重新氧化為元素硫(圖3)。9)。與此解釋相一致,我們發現,粉紅色漿果迅速氧化硫化物(圖6 A)和的積累34在PB-PSB1 S-標簽被依賴于硫酸鹽還原細菌(圖的活性8 C)。當鉬酸鈉抑制硫酸鹽還原時,未觀察到Sulfur-34富集。雖然將“特定”抑制劑(例如鉬酸鹽)應用于混合微生物種群可能會對非目標生物產生意想不到的后果(Oremland和Capone,1988年),但我們已經通過證明紅外線不會直接抑制PB-PSB1在外源硫化物存在的情況下,在短時間(1-4小時)孵育期間的光依賴性碳固定(圖8 D)。在較長的溫育,其中外源硫化物成為限制性的(4天),鉬酸治療減少碳(圖的光依賴性固定8 C)。SRB抑制導致初級生產力的降低支持了這樣的假設,即自養供應的硫化物緩沖液PB-PSB1免受間歇性硫化物剝奪。
在確定了粉紅色漿果中硫酸鹽還原的重要性之后,我們試圖描述粉紅色漿果中還原硫的池。PB-SRB1和PB-PSB1的密切物理關聯(圖4)表明還原硫物質的再氧化發生在非常短的時空尺度上。以前使用克拉克型硫化物微電極的研究無法檢測到硫化物(Seitz等,1993年),我們只能偶爾使用微伏安法和克拉克型硫化物微電極測量非常大的聚集體中微摩爾濃度的硫化物(圖.6乙)。硫化物池的短暫性質支持我們在這種密切耦合的代謝伙伴關系中快速消耗硫化物的預測。在我們描述的條件下,觀察到粉紅色漿果是硫化物的凈消費者。然而,消費和生產之間的這種平衡可能受到許多因素(例如光周期的強度和持續時間、溫度、電子供體供應)的影響,需要進一步研究以更好地闡明聚生體中硫化物通量的決定因素。
在漿果中檢測到的這種硫化物的最可能來源是PB-SRB1對硫酸鹽的還原。然而,硫化物也可以通過其他幾種代謝過程產生(圖9),包括:(i)PB-SRB1還原元素硫,(ii)PB-SRB1使元素硫或硫代硫酸鹽歧化或(iii)PB-PSB1對儲存的碳水化合物進行暗相呼吸并伴隨周質元素硫儲備的減少,產生聚羥基鏈烷酸酯和硫化物(van Gemerden,1968年;Rothermich等,2000年)。為了進一步了解粉紅色漿果硫循環的地球化學,我們表征了這種漿果內硫化物的空間分布和穩定同位素組成。
硫的氧化池和還原池之間穩定同位素比率的差異被廣泛用于硫循環的現代和古生態重建(Canfield和Teske,1996年;Habicht等人,1998年;Canfield,2001年;Hurtgen等人,2005年;Fike等人,2006年;Fike和Grotzinger,2008年;Sim等人,2011a)。由無氧光養生物(例如PB-PSB1)介導的硫化物氧化被認為對硫同位素的分餾影響很小(Ivanov等人,1977年;Fry等人,1984年;1985年;Zerkle等人,2009年)。然而,硫酸鹽還原和硫歧化都可以產生相對于起始硫酸鹽庫而言重穩定同位素顯著耗盡的硫化物(Canfield,2001年;Sim等,2011a)。盡管廣泛使用硫同位素分餾來推斷硫循環,但我們對這些測量中編碼的微生物代謝信息的理解主要基于單一物種的純培養研究(Kaplan和Rittenberg,1964年;Kemp和Thode,1968年;Sim et al.,2011b)或在微生物群落特征較差的原位地球化學測量中(Habicht和Canfield,2001;Brüchert,2004)。
毫米大小的粉紅色漿果聚生體提供了一個約束良好的多物種生態系統,可以在其中檢查硫同位素組成(δ微米級空間變化34 S硫化物)的。在銀線上使用硫化物捕獲,該技術最初用于放射性示蹤劑35 S測量(Cohen,1984年;Visscher等人,2000年;Dubilier等人,2001年),結合SIMSδ34 S測量,闡明了增加的梯度硫化物濃度和同位素消耗(較低的δ34從外圍到大粉紅色漿果中心的S值)(圖7)。在漿果中觀察到的這些同位素地球化學梯度類似于到的δ34 S硫化物從銀盤上SIMS橫斷面觀察趨勢,穿過格雷羅內格羅光合墊的氧化層(Fike和Grotzinger,2008年;Fike等人,2008年;2009年)。
在漿果中觀察到的硫化物-硫酸鹽分餾范圍(外圍15‰至聚集體中心53‰)與硫酸鹽還原菌純培養物報告的值一致,范圍從0‰到66‰(Sim等,2011a)。大的同位素分餾,例如在漿果中心觀察到的那些,可以由(i)緩慢生長的硫酸鹽還原細菌與難治性或生長限制濃度的電子供體一起產生(Sim等人,2011a,b;Leavitt等人,2013年),或(ii)還原和氧化過程耦合代謝活動的逐步方式(例如PB-PSB1的光養硫化物氧化或PB-SRB1的中間氧化態硫歧化;參見支持信息S1更詳細地討論可能產生觀察到的同位素梯度的機制)。
在屬中培養的PB-SRB1 Desulfofustis和Desulfocapsa親緣關系能夠進行硫酸鹽還原和元素硫或硫代硫酸鹽的歧化(Finster,2008年),證實了我們的同位素發現,這表明歧化可能有助于粉紅色漿果硫化物池。生態生理學和基因組數據都強烈支持PB-SRB1能夠還原硫酸鹽的結論,盡管PB-SRB1使元素硫或硫代硫酸鹽歧化的基因組證據仍然不太清楚。盡管最近對測序,但歧化所需的確切基因組仍然未知Desulfocapsa sulfexigens(劑)進行一種不能進行硫酸鹽還原的硫歧化了(Finster等人,2013年)。除了亞硫酸鹽氧化還原酶(Frederiksen and Finster,硫歧化途徑似乎涉及許多用于硫酸鹽還原的相同基因,在2003)外,PB-SRB1和D.sulfexigens(Finster等人,2013年)。
在純培養中,只有在硫化物匯存在的情況下才描述了元素硫歧化的生長,該硫化物匯保持外源硫化物濃度低,為該反應提供熱力學有利條件(Canfield等人,1998年;Finster,2008年)。PB-PSB1對硫化物的光養消耗在聚生體中提供了一個生物硫化物匯,可以為元素硫歧化創造一個有吸引力的生態位,具有豐富的硫沉積物和低濃度的硫化物。如果硫化物達到更高的濃度,多硫化物的歧化可能成為PB-SRB1代謝策略的重要組成部分。最近對厭氧甲烷氧化財團的研究表明,至少一些硫酸鹽還原財團成員可以通過元素硫與硫化物的非生物反應使硫化環境中形成的二硫化物不成比例(Milucka等,2012)。
結論
追蹤在天然微生物群落中驅動微尺度生物地球化學過程的種間代謝交換仍然是一項技術挑戰。例如,層狀光合微生物墊中的生物地球化學循環已經研究了幾十年(例如Canfield和Des Marais,1993年;Decker等人,2005年;Baumgartner等人,2009年;Petroff等人,2011年),但微生物相互作用控制底物通量(Burow等人,2013年)和地球化學特征(Fike和Grotzinger,2008年;Fike等人,2008年)才剛剛開始被理解。使用粉紅色漿果,我們展示了如何使用綜合微生物學和微地球化學方法來解密在微觀尺度上驅動硫循環的微生物代謝伙伴關系。這種方法最終可能用于檢查更復雜的生態系統,提供了同養種間硫轉移的直接證據。
硫化物豐度和同位素組成空間梯度的SIMS分析為這種微尺度硫循環提供了地球化學背景。我們發現值得注意的是,即使在這個描述充分、多樣性有限的系統中,觀察到的硫化物同位素變化也可以用許多不同的合理場景來解釋,從單獨的硫酸鹽還原到一系列耦合的還原和氧化過程(另見支持信息S1)。這種模糊性表明,單獨使用此類數據重建更復雜的沉積系統(包括古代和現代)中的硫循環時應該小心。雖然我們已經證明了硫循環的一部分(硫酸鹽還原和硫化物氧化)的活性,但我們的工作和其他基于硫的同養物(Norlund等人,2009年;Milucka等人,2012年)的數據表明,也可能存在存在一個涉及中間氧化態硫物質(例如元素硫、二硫化物、硫代硫酸鹽)的代謝相互作用網絡,仍有待探索。
《鹽堿地沼澤中的光養粉紅色貝類的微量硫循環》——概括 、介紹
 相關新聞
相關新聞